Nove publikacije
Ugotovljena ključna beljakovina za preprečevanje izgube kostne mase pri osteoporozi
Zadnji pregled: 02.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
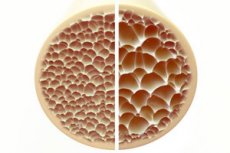
Osteoporoza, stanje, za katero so značilne porozne in krhke kosti, predstavlja veliko grožnjo za zdravje okostja. Kosti kot primarna strukturna opora človeškega telesa zagotavljajo vitalno oporo. Ko se kostna masa zmanjša, se ne le poslabša ta opora, temveč se poslabša tudi splošno delovanje, kar vodi v zmanjšano kakovost življenja.
Ker se incidenca osteoporoze pri starajočem se prebivalstvu povečuje, se povečuje breme zdravstvenih virov za dolgotrajno oskrbo. Zato je treba razumeti mehanizme, ki prispevajo k razvoju osteoporoze, in razviti učinkovita ciljno usmerjena zdravljenja za zmanjšanje njenih dolgoročnih posledic.
Osteoblasti in osteoklasti sta dve vrsti celic, ki igrata ključno vlogo pri vzdrževanju in preoblikovanju kostnega tkiva. Medtem ko so osteoblasti celice, ki tvorijo kost in so odgovorne za sintezo in odlaganje novega kostnega tkiva, so osteoklasti celice, ki razgrajujejo kost in sodelujejo pri razgradnji in odstranjevanju starega ali poškodovanega kostnega tkiva.
Povečanje deleža osteoklastov vodi do izgube kostne mase pri stanjih, kot so osteoporoza, revmatoidni artritis (vnetje sklepov) in kostne metastaze (rak, ki se je razširil na kosti). Osteoklasti nastanejo z diferenciacijo makrofagov ali monocitov, ki so vrsta imunskih celic.
Zato lahko zaviranje diferenciacije osteoklastov služi kot terapevtska strategija za preprečevanje izgube kostne mase. Vendar natančni molekularni mehanizmi, ki uravnavajo kompleksen proces preoblikovanja kosti, ostajajo nejasni.
V novi študiji so profesor Tadayoshi Hayata, g. Takuto Konno in ga. Hitomi Murachi z Univerze za znanost v Tokiu skupaj s kolegi proučili molekularno regulacijo diferenciacije osteoklastov. Stimulacija z ligandom receptorja aktivatorja jedrskega faktorja kappa B (RANKL) povzroči diferenciacijo makrofagov v osteoklaste.
Poleg tega so signalne poti kostnega morfogenetskega proteina (BMP) in transformirajočega rastnega faktorja (TGF)-β vpletene v regulacijo diferenciacije osteoklastov, ki jo posreduje RANKL. V trenutni študiji so raziskovalci želeli raziskati vlogo Ctdnep1, fosfataze (encima, ki odstranjuje fosfatne skupine), za katero so poročali, da zavira signalne poti BMP in TGF-β.
Študija je objavljena v reviji Biochemical and Biophysical Research Communications.
Profesor Hayata pravi: »RANKL deluje kot 'pospeševalnik' za diferenciacijo osteoklastov. Vožnja avtomobila zahteva ne le pospeševalnik, temveč tudi zavore. Tukaj smo ugotovili, da Ctdnep1 deluje kot 'zavora' pri diferenciaciji osteoklastov.«
Raziskovalci so najprej preučili izražanje Ctdnep1 v mišjih makrofagih, zdravljenih z RANKL, in v netretiranih kontrolnih celicah. Opazili so, da se izražanje Ctdnep1 ni spremenilo kot odziv na stimulacijo z RANKL. Vendar pa je bil v makrofagih lokaliziran v citoplazmi v granularni obliki in diferenciran v osteoklaste, kar se razlikuje od njegove normalne perinuklearne lokalizacije v drugih tipih celic, kar kaže na njegovo citoplazemsko funkcijo pri diferenciaciji osteoklastov.
Poleg tega je zmanjšanje izražanja gena Ctdnep1 (znižanje izražanja genov) povzročilo povečanje števila osteoklastov, pozitivnih na tartratno odporno kislo fosfatazo (TRAP), kjer je TRAP označevalec diferenciranih osteoklastov.
Izločitev Ctdnep1 je povzročila povečano izražanje ključnih markerjev diferenciacije, vključno z "Nfatc1", glavnim transkripcijskim faktorjem, ki ga RANKL inducira za diferenciacijo osteoklastov. Ti rezultati podpirajo "zavorno funkcijo" Ctdnep1, pri čemer negativno uravnava diferenciacijo osteoklastov. Poleg tega je izločitev Ctdnep1 povzročila tudi povečano absorpcijo kalcijevega fosfata, kar kaže na zaviralno vlogo Ctdnep1 pri resorpciji kosti.
Končno, čeprav izločanje Ctdnep1 ni spremenilo signalizacije BMP in TGF-β, so celice s pomanjkanjem Ctdnep1 pokazale povečane ravni fosforiliranih (aktiviranih) beljakovin, ki so produkti signalne poti RANKL. Ti rezultati kažejo, da zaviralni učinek Ctdnep1 na diferenciacijo osteoklastov morda ni posredovan prek signalizacije BMP in TGF-β, temveč prek znižane regulacije signalne poti RANKL in ravni beljakovin Nfatc1.
Na splošno ti rezultati ponujajo nov vpogled v proces diferenciacije osteoklastov in opredeljujejo potencialne terapevtske tarče, ki bi jih lahko uporabili za razvoj zdravljenja za zmanjšanje izgube kostne mase zaradi prekomerne aktivnosti osteoklastov. Poleg bolezni, za katere je značilna izguba kostne mase, je bil Ctdnep1 identificiran tudi kot vzročni dejavnik meduloblastoma, možganskega tumorja v otroštvu. Avtorji so optimistični, da se bodo njihove raziskave lahko razširile na druge človeške bolezni, ki presegajo presnovo kosti.
Profesor Hayata zaključuje: »Naši rezultati kažejo, da je Ctdnep1 potreben za preprečevanje prekomerne osteoklastogeneze. Ti rezultati lahko še dodatno razširijo naše znanje o tem, kako fosforilacijsko-defosforilacijsko omrežje nadzoruje diferenciacijo osteoklastov, in lahko zagotovijo nove terapevtske strategije za zdravljenje kostnih bolezni, povezanih s prekomerno aktivnostjo osteoklastov.«
