Nove publikacije
Zdravilo LM11A-31 v preskušanju upočasnjuje napredovanje Alzheimerjeve bolezni
Zadnji pregled: 02.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.

V nedavni študiji, objavljeni v reviji Nature Medicine, so znanstveniki izvedli randomizirano, dvojno slepo, s placebom nadzorovano študijo faze 2a, da bi preučili varnost in učinkovitost zdravila LM11A-31 pri zdravljenju Alzheimerjeve bolezni (AD) z modulacijo receptorja za nevrotrofin p75 (p75NTR).
Alzheimerjeva bolezen s poznim nastopom je najpogostejša oblika demence, za katero so značilne sinaptična odpoved, degeneracija in izguba živčnih celic. Čeprav dve vodilni zdravili za zdravljenje Alzheimerjeve bolezni ciljata na kopičenje nenormalnih proteinov amiloid-β ali tau, obravnavata le del patofiziologije. Drug pristop vključuje ciljanje na receptorje in signalna omrežja, ki vplivajo na temeljne biološke poti. Predklinične študije kažejo, da modulacija p75NTR z novo majhno kemično molekulo LM11A-31 zmanjša sinaptično izgubo, ki jo povzročata amiloid in nenormalni tau.
Opis študije
V tem randomiziranem kliničnem preskušanju so raziskovalci preučili, ali bi LM11A-31 lahko upočasnil napredovanje Alzheimerjeve bolezni z moduliranjem p75NTR pri ljudeh.
Udeleženci študije so 242 bolnikom z blago do zmerno astmo 26 tednov dajali peroralne kapsule LM11A-31 v odmerkih 200 mg in 400 mg ali placebo v razmerju 1:1:1. Udeleženci so imeli biološko potrjeno Alzheimerjevo bolezen (raven amiloidnega β proteina 42 (Aβ42) v cerebrospinalni tekočini pod 550 ng/L ali razmerje Aβ42:β40 pod 0,89), diagnosticirano po McKhannovih kriterijih, z rezultati Mini-Psychiatric Examination (MMSE) od 18 do 26, rezultati Geriatric Depression Scale (GDS) pod 5,0, rezultati modificirane Hachinskijeve ishemične lestvice (HIS) ≤ 4,0, formalno izobrazbo ≥ 8 let in predhodnim kognitivnim upadom ≥ 6 mesecev.
Upravičeni udeleženci so pred vključitvijo v študijo jemali zaviralce acetilholinesteraze (AChEI) ali delne antagoniste receptorjev NMDA ≥ 3 mesece. Niso jemali prepovedanih drog, kot so antipsihotiki, benzodiazepini, antiepileptiki, sedativi, centralno delujoči antihipertenzivi, nootropiki (razen ginka bilobe) ali analgetiki, ki vsebujejo opioide.
Primarni izid študije je bila varnost in prenašanje, ocenjena z uporabo lestvice za ocenjevanje resnosti suicidalnih misli in vedenja Columbia (C-SSRS), vitalni znaki, krvni tlak in hematološki parametri. Za oceno sekundarnih kognitivnih izidov so bili uporabljeni strukturno magnetno resonančno slikanje (cMRI), pozitronska emisijska tomografija s fluorodeoksiglukozo (FDG-PET) in biomarkerji cerebrospinalne tekočine (CSF). Meritve AD so vključevale Thr181-fosforiliran tau, celotni tau protein, Aβ40, Aβ42 in aktivnost AChE. Ekipa je uporabila prilagojen nevropsihološki test za oceno sekundarnih kognitivnih izidov na začetku, v 12. in 26. tednu.
Rezultati raziskav
Študija je pokazala, da je zdravilo LM11A-31 varno in dobro prenašano, brez pomembnih varnostnih pomislekov. Najpogostejši neželeni učinki so bili glavobol, driska, eozinofilija in nazofaringitis, pri čemer so bile prebavne težave in eozinofilija glavna razloga za prekinitev zdravljenja. V skupini, ki je prejemala 400 mg, je bilo več prekinitev zdravljenja v primerjavi s skupinama, ki je prejemala 200 mg, in placebo. Slikanje z magnetno resonanco ni pokazalo varnostnih pomislekov, vključno z nepravilnostmi, povezanimi z amiloidom. Med obema zdravljenima skupinama ni bilo pomembnih razlik v kognitivnih rezultatih ali amiloidnih nepravilnostih.
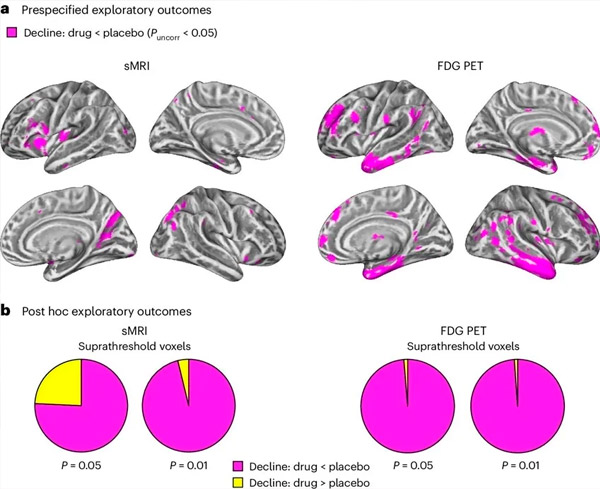
A. Dvosmerna analiza mešanih modelov kovariance je preučevala interakcije med zdravljenjem (zdravilo ali placebo) in časom (pred ali po zdravljenju). Enostranski t-kontrast, ki je preučeval hipotezo o interakciji (zdravilo upočasni napredovanje v primerjavi s placebom), je pokazal, da je zdravljenje z LM11A-31 upočasnilo vzdolžno degeneracijo (levi paneli) in hipometabolizem glukoze (desni paneli) v skupini, ki je prejemala zdravilo (cMRI, n = 127; PET, n = 121), v primerjavi s skupino, ki je prejemala placebo (cMRI, n = 66; PET, n = 62). Vokseli, ki kažejo to interakcijo, so prikazani pri nekorigiranem pragu P < 0,05 (magenta) na populacijsko specifični površini možganske skorje. Leva in desna hemisfera sta prikazani v zgornji oziroma spodnji vrstici. Možganske regije, ki kažejo interakcije, ki niso skladne s hipotezo, so prikazane na sliki 7 v dodatnih podatkih.
B. Skupno število vokselov v vnaprej določenih ranljivih možganskih regijah za Alzheimerjevo bolezen (skupna površina tortnih diagramov), ki kažejo bodisi interakcijo v skladu s hipotezo (magenta) bodisi interakcijo, ki ni skladna s hipotezo (rumena) v vsaki slikovni metodi (cMRI, leva plošča; FDG PET, desna plošča) pri vse bolj liberalnih pragih nekorigiranega P < 0,01 in P < 0,05. Monte Carlo simulacije so pokazale, da so bila razmerja vokselov, ki kažejo učinke v skladu s hipotezo, v primerjavi z učinki, ki niso skladni s hipotezo, bistveno višja od tistih, ki so bila opažena na podlagi naključno generiranih podatkov za cMRI in PET (P < 0,001 za vsako modaliteto; dvostranski test).
LM11A-31 je učinkovito zmanjšal povečanje Aβ42 in Aβ40 v cerebrospinalni tekočini v primerjavi s skupino, ki je prejemala placebo. Zdravilo je pokazalo tudi zmanjšanje mediane letne odstotne spremembe presinaptičnega proteinskega biomarkerja SNAP25 in zmanjšanje postsinaptičnega biomarkerja NG, kar kaže na upočasnitev izgube presinaptičnih in postsinaptičnih povezav. LM11A-31 je zmanjšal tudi povečanje YKL40, kar je povzročilo znižanje rezultatov MMSE in zvišanje rezultatov ADAS-Cog-13. Zdravilo je tudi zmanjšalo izgubo sive snovi v čelnem režnju in posteriorni parietalni skorji ter zmanjšanje presnove glukoze na področjih, kot so entorhinalni korteks, temporalni korteks, hipokampus, inzularni korteks in prefrontalni korteks.
Zaključek
Študija je zaključila, da je modulacija p75NTR z LM11A-31 primerna za obsežnejša klinična preskušanja. LM11A-31 je dosegel primarni varnostni cilj in so ga bolniki z blago do hudo Alzheimerjevo boleznijo dobro prenašali. Rezultati kažejo na potrebo po nadaljnjih študijah z daljšim trajanjem zdravljenja, da bi ocenili potencial majhnih molekul za regulacijo p75NTR kot terapije, ki spreminja bolezen pri Alzheimerjevi bolezni. Študija je pokazala, da LM11A-31 pomembno vpliva na več biomarkerjev, vključno z Aβ40, Aβ42, SNAP25, NG in YKL40, kar kaže na upočasnitev patološkega napredovanja. Prihodnje študije lahko ocenijo dodatne kazalnike zdravja glije.
