Zdravilo LM11A-31 upočasni napredovanje Alzheimerjeve bolezni v preskušanju
Zadnji pregled: 14.06.2024

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.

V nedavni študiji, objavljeni v Nature Medicine, so raziskovalci izvedli randomizirano, dvojno slepo, s placebom nadzorovano preskušanje faze 2a, da bi preučili varnost in učinkovitost LM11A-31 pri zdravljenju Alzheimerjeve bolezni (AD) prek modulacija nevrotrofinskega receptorja p75 (p75NTR).
AD s poznim nastopom je najpogostejša oblika demence, za katero so značilni sinaptična odpoved, degeneracija in izguba živčnih celic. Čeprav dve glavni zdravili za zdravljenje AD ciljata na kopičenje nenormalnega proteina amiloid-β ali tau, obravnavata le del patofiziologije. Drug pristop je ciljanje na receptorje in signalna omrežja, ki vplivajo na temeljne biološke poti. Predklinične študije kažejo, da modulacija p75NTR z novo majhno molekulo LM11A-31 zmanjša sinaptično izgubo, ki jo povzročata amiloid in patološki tau.
Opis študije
V tem randomiziranem kliničnem preskušanju so raziskovalci preučevali, ali lahko LM11A-31 upočasni napredovanje Alzheimerjeve bolezni z modulacijo p75NTR pri ljudeh.
Udeleženci študije so 242 bolnikom z blago do zmerno astmo 26 tednov prejemali peroralne kapsule LM11A-31 v odmerkih 200 mg in 400 mg ali placebo v razmerju 1:1:1. Udeleženci so imeli biološko potrjeno Alzheimerjevo bolezen (raven amiloidnega β proteina 42 (Aβ42) v cerebrospinalni tekočini pod 550 ng/l ali razmerje Aβ42:β40 pod 0,89), diagnosticirano po McKhannovih kriterijih, z rezultati Mini Psychiatric SE (MMSE) od 18 do 26, Rezultati na lestvici geriatrične depresije (GDS) pod 5,0, rezultati na modificirani ishemični lestvici Hacinski (HIS) ≤ 4,0, formalna izobrazba ≥ 8 let in prejšnji kognitivni upad ≥ 6 mesecev.
Upravičeni udeleženci so jemali zaviralce acetilholinesteraze (AChEI) ali delne antagoniste receptorjev NMDA ≥ 3 mesece pred vključitvijo v študijo. Niso jemali prepovedanih drog, kot so antipsihotiki, benzodiazepini, antiepileptiki, pomirjevala, centralno delujoči antihipertenzivi, nootropiki (razen ginka bilobe) ali analgetiki, ki vsebujejo opioide.
Primarni izid študije je bila varnost in prenašanje zdravila, ocenjena s Columbia Columbia Suicidal Ideation and Behavior Severity Rating Scale (C-SSRS), vitalni znaki, krvni tlak in hematološki parametri. Slikanje s strukturno magnetno resonanco (sMRI), pozitronska emisijska tomografija s fluorodeoksiglukozo (FDG-PET) in biomarkerji cerebrospinalne tekočine (CSF) so bili uporabljeni za oceno sekundarnih kognitivnih rezultatov. Indikatorji AD so vključevali tau, fosforiliran pri Thr181, skupni protein tau, aktivnost Aβ40, Aβ42 in AChE. Ekipa je uporabila individualiziran nevropsihološki test za oceno sekundarnih kognitivnih rezultatov na začetku, 12. In 26. Tednu.
Rezultati raziskav
Študija je pokazala, da je LM11A-31 varen in ga dobro prenašajo, brez večjih pomislekov glede varnosti. Najpogostejši stranski učinki so bili glavobol, driska, eozinofilija in nazofaringitis, gastrointestinalne težave in eozinofilija pa so bili glavni razlogi za ukinitev zdravila. V skupini s 400 mg je bilo več prekinitev v primerjavi s skupinama z 200 mg in placebom. MRI ni odkril nobenih pomislekov glede varnosti zdravila, vključno z nepravilnostmi, povezanimi z amiloidom. Med obema skupinama zdravljenja ni bilo pomembnih razlik v kognitivnih rezultatih ali amiloidnih nepravilnostih.
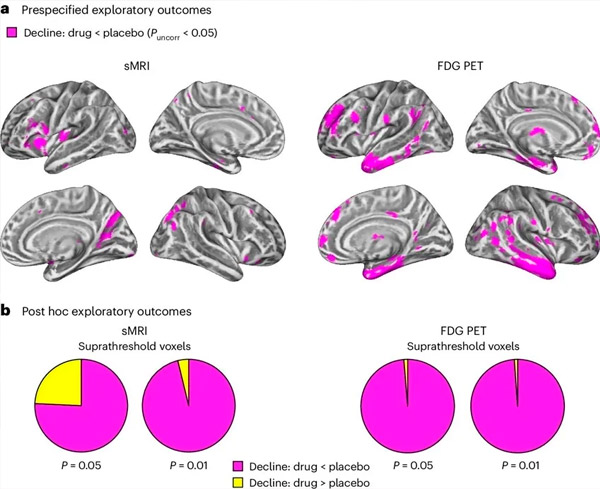
A. Dvofaktorske mešane analize kovarianc so preučevale interakcije med zdravljenjem (zdravilo ali placebo) in časom (pred ali po zdravljenju). Enosmerni t-kontrast, ki preučuje hipotezo o interakciji (zdravilo upočasni napredovanje v primerjavi s placebom), je pokazal, da je zdravljenje z LM11A-31 upočasnilo vzdolžno degeneracijo (leve plošče) in hipometabolizem glukoze (desne plošče) v skupini, zdravljeni z zdravilom (cMRI, n = 127; n = 121), v primerjavi s placebo skupino (sMRI, n = 66; PET, n = 62). Vokseli, ki prikazujejo to interakcijo, so prikazani pri nepopravljenem pragu P < 0,05 (magenta barva) na kortikalni površini, specifični za populacijo. Leva in desna polobla sta prikazani v zgornji oziroma spodnji vrstici. Območja možganov, ki kažejo interakcije, ki niso skladne s hipotezo, so prikazane na sliki 7 v dodatnih podatkih.
b. Skupno število vokslov v vnaprej določenih ranljivih možganskih regijah AD (skupna površina tortnih grafikonov), ki prikazujejo interakcijo, ki je skladna s hipotezo (magentna barva) ali interakcija, ki ni skladna s hipotezo (rumena barva) v vsakem od načinov slikanja (cMRI, leva plošča; FDG PET, desna plošča) pri vse bolj liberalnih neprilagojenih pragovih P < 0,01 in P < 0,05. Simulacije Monte Carlo so pokazale, da so razmerja vokslov, ki kažejo učinke, ki so skladni s hipotezo, v primerjavi s tistimi, ki niso skladni s hipotezo, znatno višja od tistih, opaženih iz naključno ustvarjenih podatkov za cMRI in PET ( P
LM11A-31 je učinkovito zmanjšal povečanje Aβ42 in Aβ40 v CSF v primerjavi s placebo skupino. Zdravilo je pokazalo tudi zmanjšanje mediane letne odstotne spremembe v presinaptičnem proteinskem biomarkerju SNAP25 in zmanjšanje v postsinaptičnem biomarkerju NG, kar kaže na upočasnitev izgube presinaptičnih in postsinaptičnih povezav. LM11A-31 je tudi zmanjšal rast YKL40, kar je povzročilo znižanje rezultatov MMSE in povečanje rezultatov ADAS-Cog-13. Zdravilo je prav tako zmanjšalo izgubo sive snovi v čelnem režnju in posteriornem parietalnem korteksu ter zmanjšalo presnovo glukoze na področjih, kot so entorinalna skorja, temporalna skorja, hipokampus, insularni korteks in prefrontalni korteks.
Zaključek
Študija je zaključila, da je modulacija p75NTR z LM11A-31 primerna za večja klinična preskušanja. LM11A-31 je izpolnjeval primarni varnostni kriterij in so ga bolniki z blagimi do hudimi oblikami astme dobro prenašali. Rezultati kažejo na potrebo po nadaljnjih študijah z daljšim trajanjem zdravljenja, da bi ocenili izvedljivost uporabe majhnih molekul za uravnavanje p75NTR kot terapije za spreminjanje bolezni pri AD. Študija je pokazala, da je LM11A-31 pomembno vplival na več biomarkerjev, vključno z Aβ40, Aβ42, SNAP25, NG in YKL40, kar kaže na zmanjšanje patološkega razvoja. Prihodnje študije bodo morda ovrednotile dodatne indikatorje zdravja glije.
