Nove publikacije
Zaradi mutacije gena ARID1A so tumorji občutljivi na imunoterapijo
Zadnji pregled: 02.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Imunoterapija je v zadnjih letih povzročila revolucijo v zdravljenju raka. Namesto neposrednega ciljanja na tumorje imunoterapija usmerja bolnikov imunski sistem k učinkovitejšemu napadu na tumorje. To je še posebej učinkovito pri nekaterih težko ozdravljivih vrstah raka. Vendar pa se na trenutne imunoterapije odzove manj kot polovica vseh bolnikov z rakom, kar ustvarja nujno potrebo po identifikaciji biomarkerjev, ki lahko napovedo, kateri bolniki bodo najverjetneje imeli koristi od zdravljenja.
Nedavno so znanstveniki opazili, da se bolniki, katerih tumorji imajo mutacijo v genu ARID1A, pogosteje pozitivno odzivajo na blokado imunskih kontrolnih točk, vrsto imunoterapije, ki deluje tako, da ohranja aktivirane imunske celice, ki se borijo proti raku.
Ker je mutacija gena ARID1A prisotna pri številnih vrstah raka, vključno z rakom endometrija, jajčnikov, debelega črevesa in danke, želodca, jeter in trebušne slinavke, so se raziskovalci Salkovega inštituta spraševali, kako bi lahko prispevala k občutljivosti zdravljenja in kako bi lahko zdravniki te informacije uporabili za personalizacijo zdravljenja raka za vsakega bolnika.
Njihova nova študija, objavljena v reviji Cell, kaže, da mutacija ARID1A naredi tumorje občutljive na imunoterapijo, tako da s pomočjo protivirusnega imunskega odziva rekrutira imunske celice, ki se borijo proti raku, na tumor.
Raziskovalci menijo, da bi se ta mutacija in protivirusni imunski odziv lahko uporabila kot biomarker za boljšo izbiro bolnikov za specifične imunoterapije, kot je blokada imunskih kontrolnih točk. Te ugotovitve spodbujajo tudi razvoj zdravil, ki ciljajo na ARID1A in sorodne beljakovine, da bi drugi tumorji postali občutljivejši na imunoterapijo.
»To bi lahko resnično spremenilo izid zdravljenja raka pri bolnikih,« je dejala izredna profesorica Diana Hargreaves, višja avtorica študije. »Bolniki z mutacijo ARID1A že imajo imunski odziv, zato moramo le še okrepiti ta odziv z blokado imunskih kontrolnih točk, da jim pomagamo uničiti tumorje od znotraj.«
Čeprav je bilo znano, da se ljudje z mutacijami ARID1A dobro odzivajo na blokado imunskih kontrolnih točk, natančna povezava med njima ostaja nejasna. Da bi osvetlili mehanizem, so znanstveniki na Salkovem inštitutu uporabili mišje modele melanoma in kolorektalnega raka z mutacijo ARID1A in funkcionalnim ARID1A.
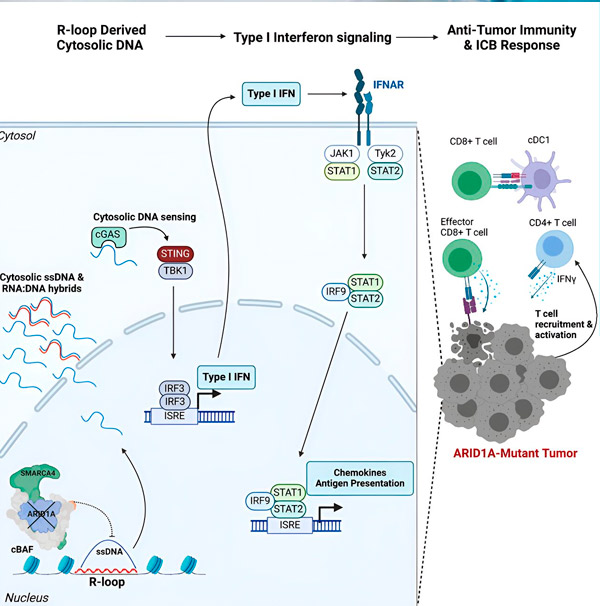
Vir: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Ekipa je opazila močan imunski odziv pri vseh modelih z mutacijo ARID1A, ne pa pri tistih, kjer je bil ARID1A funkcionalen, kar podpira idejo, da mutacija ARID1A dejansko poganja ta odziv. Toda kako to deluje na molekularni ravni?
»Ugotovili smo, da ima ARID1A pomembno vlogo v jedru, saj vzdržuje pravilno organizacijo DNK,« pravi Matthew Maxwell, prvi avtor študije in podiplomski študent v laboratoriju Hargreaves. »Brez funkcionalnega ARID1A se lahko prosta DNK izreže in sprosti v citosol, kar aktivira zaželen protivirusni imunski odziv, ki ga je mogoče okrepiti z blokado imunskih kontrolnih točk.«
Gen ARID1A kodira protein, ki pomaga uravnavati obliko naše DNK in ohranjati stabilnost genoma. Ko ARID1A mutira, sproži verigo dogodkov, podobno Rubeju Goldbergu, v rakavih celicah.
Najprej pomanjkanje funkcionalnega ARID1A povzroči sproščanje DNK v citosol. Citosolna DNK nato aktivira protivirusni alarmni sistem, pot cGAS-STING, ker so naše celice prilagojene tako, da vsako DNK v citosolu označijo kot tujo, da bi se zaščitile pred virusnimi okužbami. Navsezadnje pot cGAS-STING aktivira imunski sistem, da rekrutira celice T v tumor in jih aktivira v specializirane celice T ubijalke raka.
Na vsakem koraku, odvisno od prejšnjega, ta veriga dogodkov – mutacija ARID1A, pobeg DNK, alarm cGAS-STING, rekrutiranje celic T – vodi do povečanja števila celic T, ki se borijo proti raku, v tumorju. Blokada imunskih kontrolnih točk se nato lahko uporabi za zagotovitev, da te celice T ostanejo aktivirane, kar poveča njihovo sposobnost premaganja raka.
»Naše ugotovitve ponujajo nov molekularni mehanizem, s katerim lahko mutacija ARID1A prispeva k protitumorskemu imunskemu odzivu,« pravi Hargreaves. »Kar je pri teh ugotovitvah vznemirljivo, je njihov translacijski potencial. Mutacije ARID1A lahko uporabimo za izbiro bolnikov za blokado imunskih kontrolnih točk in zdaj vidimo mehanizem, s katerim bi lahko zdravila, ki zavirajo ARID1A ali njegov proteinski kompleks, uporabili za nadaljnje izboljšanje imunoterapije pri drugih bolnikih.«
Z opisom mehanizma, s katerim je blokada imunskih kontrolnih točk učinkovitejša pri rakih z mutacijo ARID1A, raziskovalci zdravnikom nudijo utemeljitev za dajanje prednosti tej imunoterapiji pri bolnikih z mutacijo ARID1A. Te ugotovitve so pomemben korak k personalizaciji zdravljenja raka in navdihujejo razvoj novih terapij, ki ciljajo na ARID1A in njegov beljakovinski kompleks.
Ekipa Salkovega inštituta upa, da bodo njihove ugotovitve v prihodnje izboljšale izide zdravljenja bolnikov z različnimi vrstami raka, povezanimi z mutacijami ARID1A, in namerava raziskati ta klinični prevod v sodelovanju z Univerzo v Kaliforniji v San Diegu.
