Nove publikacije
Spanje očisti možgane toksinov in metabolitov
Zadnji pregled: 02.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.

Nedavna študija, objavljena v reviji Nature Neuroscience, je pokazala, da se čiščenje možganov med anestezijo in spanjem zmanjša.
Spanje je stanje ranljive neaktivnosti. Glede na tveganja te ranljivosti se domneva, da ima lahko spanje nekatere koristi. Domneva se, da spanje odstranjuje toksine in presnovke iz možganov prek glimfatičnega sistema. Ta domneva ima pomembne posledice; na primer, zmanjšano odstranjevanje toksinov zaradi kronično slabega spanca lahko poslabša Alzheimerjevo bolezen.
Mehanizmi in anatomske poti, po katerih se toksini in presnovki odstranjujejo iz možganov, ostajajo nejasni. V skladu z glimfatično hipotezo bazalni pretok tekočine, ki ga poganjajo hidrostatični gradienti tlaka zaradi arterijskih pulzacij, aktivno odstranjuje soli iz možganov med počasnim spanjem. Poleg tega sedativni odmerki anestetikov povečajo odvajanje. Ali spanje poveča odvajanje s povečanim bazalnim pretokom, ostaja neznano.
V tej študiji so raziskovalci merili gibanje tekočine in očistek možganov pri miših. Najprej so določili difuzijski koeficient fluorescein izotiocianata (FITC)-dekstrana, fluorescentnega barvila. FITC-dekstran so injicirali v repato jedro, fluorescenco pa so merili v frontalnem korteksu.
Začetni poskusi so vključevali čakanje na ustaljeno stanje, beljenje barvila v majhnem volumnu tkiva in določanje difuzijskega koeficienta z merjenjem hitrosti premikanja nebeljenega barvila v beljeno območje. Tehnika je bila validirana z merjenjem difuzije FITC-dekstrana v agaroznih gelih, ki simulirajo možgane in so bili modificirani tako, da so približali optično absorpcijo in sipanje svetlobe v možganih.
Rezultati so pokazali, da se difuzijski koeficient FITC-dekstrana ni razlikoval med anesteziranim in spanim stanjem. Ekipa je nato izmerila možganski klirens v različnih stanjih budnosti. Pri miših, ki so jim injicirali fiziološko raztopino ali anestetik, so uporabili majhen volumen fluorescentnega barvila AF488. To barvilo se je prosto gibalo v parenhimu in bi lahko pomagalo natančno količinsko opredeliti možganski klirens. Opravljene so bile tudi primerjave med budnim in spanim stanjem.
Pri najvišjih koncentracijah je bil očistek pri miših, zdravljenih s fiziološko raztopino, 70–80 %, kar kaže, da normalni mehanizmi očistka niso bili oslabljeni. Vendar pa se je očistek znatno zmanjšal pri uporabi anestetikov (pentobarbital, deksmedetomidin in ketamin-ksilazin). Poleg tega se je očistek zmanjšal tudi pri spečih miših v primerjavi z budnimi mišmi. Vendar se difuzijski koeficient med anesteziranim in spalnim stanjem ni bistveno razlikoval.
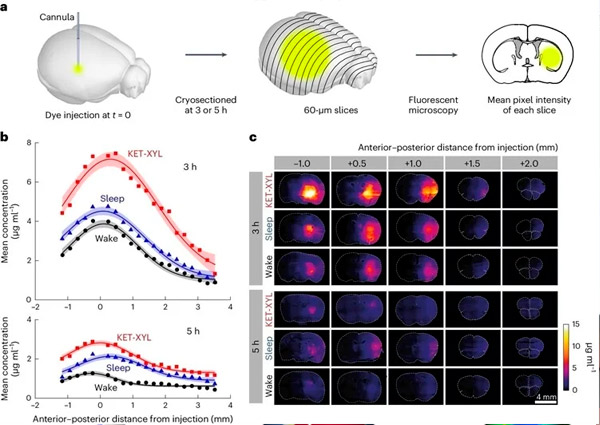
A. Tri ali pet ur po injiciranju AF488 v CPu so možgane zamrznili in narezali na 60 μm debele kriogene rezine. Povprečna intenzivnost fluorescence vsakega rezina je bila izmerjena s fluorescenčno mikroskopijo; nato so bile izračunane povprečne vrednosti povprečnih intenzivnosti skupin štirih rezin.
B. Povprečna intenzivnost fluorescence je bila pretvorjena v koncentracijo z uporabo kalibracijskih podatkov, predstavljenih na dodatni sliki 1, in prikazana glede na anteroposteriorno razdaljo od točke injiciranja za budno (črno), spanje (modro) in anestezijo s KET-XYL (rdeče) stanje. Zgornji del prikazuje podatke po 3 urah. Spodnji del prikazuje podatke po 5 urah. Črte predstavljajo Gaussove prilagoditve podatkom, stolpci napak pa prikazujejo 95-odstotne intervale zaupanja. Tako po 3 kot po 5 urah so bile koncentracije KET-XYL med anestezijo (P < 10⁻⁶ pri 3 urah; P < 10⁻⁶ pri 5 urah) in spanjem (P = 0,0016 pri 3 urah; P < 10⁻⁴ pri 5 urah) bistveno višje kot med budnostjo (dvosmerna ANOVA z Bonferroni-Holmovo korekcijo večkratne primerjave).
C. Reprezentativne slike možganskih prerezov na različnih razdaljah (anteroposteriorno) od mesta injiciranja AF488 po 3 urah (zgornje tri vrstice) in po 5 urah (spodnje tri vrstice). Vsaka vrstica predstavlja podatke za tri budna stanja (budnost, spanje in anestezija s KET-XYL).
Študija je pokazala, da se je možganski očistek med anestezijo in spanjem zmanjšal, kar je v nasprotju s prejšnjimi poročili. Očistek se lahko razlikuje glede na anatomska mesta, vendar je stopnja variacije lahko majhna. Vendar pa je bila inhibicija očistka s ketamin-ksilazinom pomembna in neodvisna od mesta.
Nicholas P. Franks, eden od avtorjev študije, je dejal: »Raziskovalno področje se je tako osredotočilo na idejo čiščenja kot enega ključnih razlogov, zakaj spimo, da so nas nasprotni rezultati zelo presenetili.«
Posebej pomembno je omeniti, da se rezultati nanašajo na majhen volumen barvila, ki se prosto giblje v zunajceličnem prostoru. Večje molekule lahko kažejo drugačno vedenje. Poleg tega natančni mehanizmi, s katerimi spanje in anestezija vplivata na čiščenje možganov, ostajajo nejasni; vendar te ugotovitve izpodbijajo idejo, da je primarna funkcija spanja čiščenje možganov toksinov.
