Nove publikacije
Študija poudarja potrebo po terapijah za HIV, ki bi bile specifične za posamezne celične tipe.
Zadnji pregled: 02.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Raziskovalci na Univerzi v Illinoisu so dokazali pomen ciljanja na specifične tipe celic pri zdravljenju virusa HIV. Njihova študija, objavljena v reviji Proceedings of the National Academy of Sciences, je ena prvih, ki preučuje diferencialne ali za tip celic specifične učinke modulacije latence virusa HIV na mieloidne celice, vrsto imunskih celic, ki se proizvajajo v kostnem mozgu.
Ena glavnih ovir za odpravo okužbe z virusom HIV je obvladovanje latence oziroma obdobja, v katerem okužena celica miruje in ne more proizvajati virusa. Latentne celice HIV se v telesu zbirajo na mestih, znanih kot rezervoarji. Latentni rezervoarji so problematični, ker lahko kadar koli začnejo proizvajati virus.
Popolna izkoreninjenost bolezni bi zahtevala odstranitev vseh latentnih celic iz telesa ali trajno odpornost na aktivacijske dražljaje. Vendar pa lahko reaktivacijo sprožijo različni dejavniki, vključno s signali, ki usmerjajo diferenciacijo mieloidnih celic.
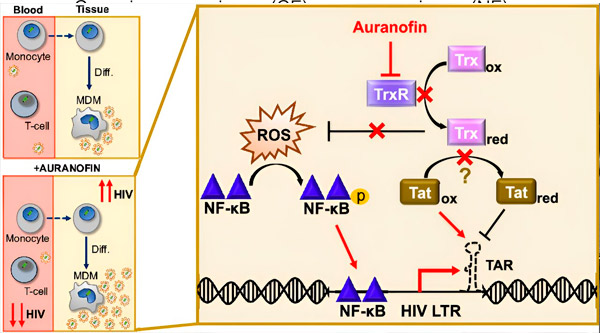
Regulacija latence HIV v makrofagih, pridobljenih iz monocitov (MDM), lahko predstavlja tveganje za širjenje virusa. Diferenciacija monocitov v makrofage lahko sproži reaktivacijo HIV, kar lahko spodbudi širjenje virusa v tkivih (zgoraj levo). Klinični kandidat, Auranofin, zmanjša virusno DNA v krvi in spodbuja latenco HIV v celicah T in monocitih, vendar povzroči reaktivacijo HIV v MDM (spodaj levo). Pri MDM domnevamo, da zaviranje TrxR z Auranofinom vodi do kopičenja reaktivnih kisikovih spojin (ROS), kar povzroči aktivacijo NF-κB in aktivacijo promotorja HIV LTR (desno). Inhibicija TrxR potencialno zmanjša redukcijo substrata, kar omogoča, da protein Tat ostane prednostno oksidiran, kjer se lahko veže na TAR in sproži transkripcijo HIV. Vir: Zbornik Nacionalne akademije znanosti (2024). DOI: 10.1073/pnas.2313823121
Raziskave zdravljenja HIV so se leta osredotočale na dva pristopa, znana kot »šokiraj in ubij« ter »blokiraj in zakleni«. Prvi deluje v kombinaciji z protiretrovirusno terapijo, da aktivira latentno okužene celice in jih ubije z apoptozo oziroma programirano celično smrtjo, medtem ko drugi okužene celice sili v globoko latentno stanje, iz katerega se same ne morejo ponovno aktivirati.
Raziskave teh tehnik so se tradicionalno osredotočale na vrsto belih krvničk, imenovanih celice T, ki so glavna tarča okužbe z virusom HIV. Vendar pa latentne rezervoarje sestavljajo več kot le celice T; pravzaprav vsebujejo na desetine različnih vrst celic, od katerih ima vsaka svoje edinstvene vzorce izražanja genov HIV.
»Obstaja ogromna raznolikost celic, celo znotraj ene same linije,« je dejal Collin Kieffer, docent mikrobiologije in avtor članka. »Spremenljivost odziva v teh rezervoarjih se povečuje z vsako novo vrsto celice.«
Alexandra Blanco, podiplomska študentka v Kiefferjevem laboratoriju, je želela preučiti celične tipe, ki so bili v tradicionalnih raziskavah HIV spregledani. Osredotočila se je na mieloidne celice in ustvarila knjižnico klonov, ki je vsebovala 70 populacij latentno okuženih monocitov. Blanco je nato analizirala klonske populacije in njihove odzive na aktivacijo. Odzivi so se zelo razlikovali, kar je poudarilo veliko raznolikost znotraj enega samega celičnega tipa.
To opažanje je sprožilo novo vprašanje: ali se različne vrste celic res različno odzivajo na zdravljenje latence HIV? Njihove ugotovitve so dejansko pokazale, da lahko nekatere terapije latence HIV spodbujajo latenco v celicah T in monocitih, hkrati pa lahko obrnejo latenco v makrofagih.
»Vse celice v telesu niso enake,« je dejal Kieffer. »Zato je smiselno, da se vse okužene celice ne bodo na virus odzvale na enak način.«
Njihov članek poudarja potrebo po tem, da prihodnja zdravljenja HIV upoštevajo vse vrste celic in kako se vsaka celica lahko odzove na morebitne terapije.
Njihove ugotovitve temeljijo na raziskavi Roya Dara, nekdanjega profesorja bioinženiringa v Illinoisu, katerega laboratorij je preučeval heterogenost v izražanju genov HIV.
»On je začel, mi pa smo ga prevzeli in ga razvili do te mere, da je danes,« je dejal Kieffer. »Sodelovanje je torej resnično prineslo te rezultate. Spremenilo se je v novo smer za naš laboratorij in resnično smo navdušeni nad tem.«
Dodatna in nepričakovana ugotovitev Blancove analize je razkrila spremembe v velikosti in obliki celic kot odziv na okužbo, kar kaže na to, da lahko HIV spremeni morfologijo celic. Blancov naslednji cilj je prepoznati biološke mehanizme, ki so podlaga za te fenotipske spremembe.
Kieffer in člani njegovega laboratorija se veselijo tudi reprodukcije svojih rezultatov, ki so bili večinoma pridobljeni na celični liniji, na primarnih celicah. Reprodukcija rezultatov v modelu, ki je bolj podoben človeku, bi izboljšala klinični pomen študije, je pojasnil Kieffer.
»Radi bi izvedli večje presejalne teste celic T, monocitov in makrofagov, da bi odkrili potencialna zdravila, ki bi lahko delovala na vse te tipe celic,« je dejal Blanco. »Morda bomo našli še več molekul, ki se ne obnašajo specifično za tipe celic.«
