Nove publikacije
TIVDAK®, ki ga je odobrila FDA: ciljno delovanje na tkivni faktor pri raku materničnega vratu
Zadnji pregled: 02.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Ameriška uprava za hrano in zdravila (FDA) je 29. aprila 2024 v celoti odobrila zdravilo TIVDAK® (tisotumab vedotin) podjetja Seagen Inc., ki deluje na tkivni faktor (TF), za zdravljenje bolnic s ponavljajočim se ali metastatskim rakom materničnega vratu, ki je napredoval med kemoterapijo ali po njej. To predstavlja pomemben preboj v zdravljenju raka materničnega vratu in poudarja potencial konjugatov protiteles in zdravil (ADC) v onkologiji.
Mehanizem delovanja zdravila TIVDAK
Tivdak je ADC, ki cilja na TF z združevanjem Genmabovega monoklonskega protitelesa proti TF tisotumaba s Seagenovo tehnologijo ADC, zasnovano za ciljanje antigenov TF na rakavih celicah in neposredno dostavo citotoksične komponente MMAE v rakave celice.
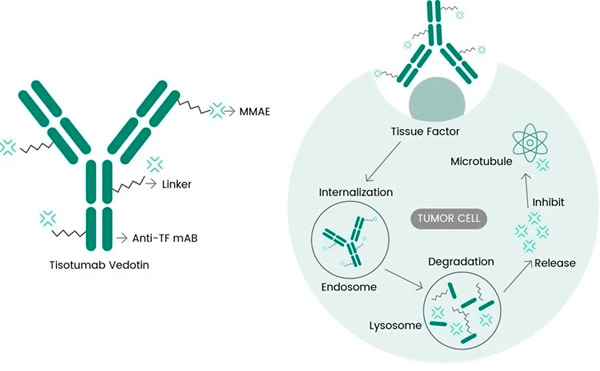
Molekularni mehanizem delovanja tizotumaba vedotina ( https://doi.org/10.3390/ijms23073559 )
TF: Popolna tarča za razvoj ADC-ja
Znano je, da je TF vključen v tumorsko signalizacijo in angiogenezo ter je prekomerno izražen pri veliki večini bolnikov z rakom materničnega vratu in številnimi drugimi solidnimi tumorji. Njegova sposobnost hitre internalizacije po vezavi protiteles in minimalen vpliv na normalno strjevanje krvi še dodatno povečujeta njegovo primernost za ciljno zdravljenje raka.
