TIVDAK® Odobreno s strani FDA: ciljanje na tkivni faktor pri raku materničnega vratu
Zadnji pregled: 14.06.2024

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
29. Aprila 2024 je ameriška uprava za hrano in zdravila (FDA) v celoti odobrila TIVDAK® (tisotumab vedotin) podjetja Seagen Inc., ki cilja na tkivni faktor (TF) za zdravljenje bolnic s ponavljajočim se ali metastatskim rakom materničnega vratu, ki je napredoval med ali po kemoterapija. To predstavlja pomemben preboj pri zdravljenju raka materničnega vratu, ki poudarja potencial konjugatov protiteles in zdravil (ADC) v onkologiji.
Mehanizem delovanja TIVDAK
Tivdak je zdravilo ADC, ki cilja na TF in združuje Genmabovo anti-TF monoklonsko protitelo tisotumab s Seagenovo tehnologijo ADC, zasnovano za ciljanje na antigene TF na rakavih celicah in dostavo citotoksičnega dela MMAE neposredno v rakave celice. p>
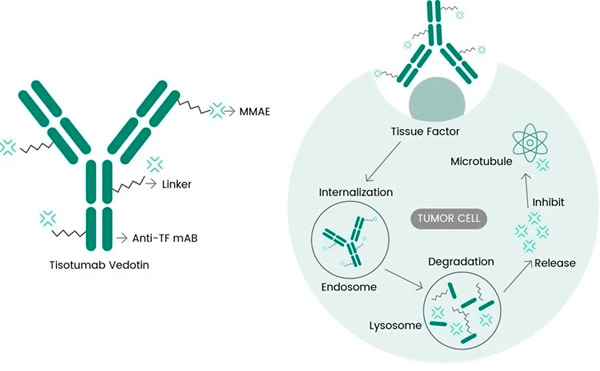
Molekularный mehanizem delovanja tisotumaba vedotina (https://doi.org/10.3390/ijms23073559)
TF: idealna miška za razvoj ADC
Izvestno je, da TF sodeluje v signalnih poteh opuholega porasta in angiogeneze ter prekomerno ekspresije pri večini bolnikov z rakom šejki matice in mnogih drugih trdnih opuholah. Njegova sposobnost se hitro internalizirati pri povezovanju antitelami in minimalni učinek na normalne procese zavrtenja dodatno poveča njegovo primernost za izbrano zdravljenje s krvno terapijo raka.
