Študija poudarja potrebo po celično specifičnih terapijah za HIV
Zadnji pregled: 14.06.2024

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Raziskovalci z Univerze v Illinoisu so dokazali pomen ciljanja na specifične vrste celic pri zdravljenju HIV. Njihova študija, objavljena v Proceedings of the National Academy of Sciences, je ena prvih, ki je preučevala diferencialne ali tipsko specifične učinke moduliranja latence virusa HIV na mieloidne celice.. Celice, vrsta imunske celice, proizvedene v kostnem mozgu.
Ena od glavnih ovir za odpravo okužbe s HIV je obvladovanje latence ali obdobja, v katerem okužena celica miruje in ne more proizvajati virusa. Latentne celice HIV se zbirajo v telesu na mestih, ki so znana kot rezervoarji. Latentni rezervoarji so problematični, ker lahko vsak trenutek začnejo proizvajati virus.
Popolno izkoreninjenje bolezni bo zahtevalo odstranitev vseh latentnih celic iz telesa ali trajno odpornost na aktivacijske dražljaje. Vendar pa lahko ponovno aktivacijo povzročijo številni dejavniki, vključno s signali, ki usmerjajo diferenciacijo mieloidnih celic.
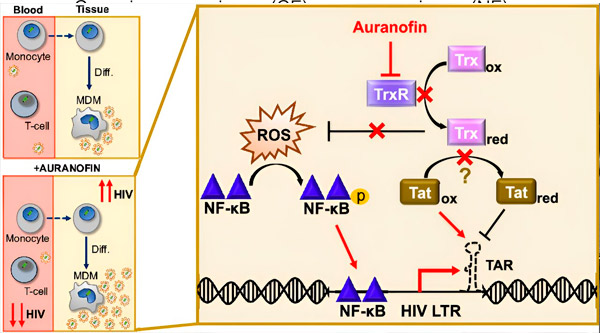
Uravnavanje latence HIV v makrofagih, pridobljenih iz monocitov (MDM), lahko predstavlja tveganje za širjenje virusa. Diferenciacija monocitov v makrofage lahko povzroči ponovno aktivacijo HIV, kar potencialno spodbuja širjenje virusa v tkiva (zgoraj levo). Klinični kandidat, Auranofin, zmanjša virusno DNA v krvi in spodbuja HIV latenco v celicah T in monocitih, vendar povzroči reaktivacijo HIV v MDM (spodaj levo). V MDM domnevamo, da inhibicija TrxR z Auranofinom vodi do kopičenja reaktivnih kisikovih vrst (ROS), kar povzroči aktivacijo NF-κB in aktivacijo HIV LTR promotorja (desno). Inhibicija TrxR potencialno zmanjša redukcijo substrata, tako da omogoči, da protein Tat ostane pretežno oksidiran, kjer se lahko veže na TAR in sproži transkripcijo HIV. Vir: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
Raziskave o zdravilu za virus HIV so se že vrsto let osredotočale na dva pristopa, znana kot "šok in ubij" ter "blokiraj in zakleni". Prvo deluje v povezavi s protiretrovirusno terapijo, da aktivira latentno okužene celice in jih ubije z apoptozo ali programirano celično smrtjo, medtem ko slednje povzroči, da okužene celice preidejo v globoko latentno stanje, iz katerega se ne morejo znova aktivirati same.
Raziskave v zvezi s temi tehnikami so se tradicionalno osredotočale na vrsto belih krvnih celic, imenovanih celice T, ki so glavna tarča okužbe s HIV. Vendar pa latentni rezervoarji niso sestavljeni samo iz celic T; pravzaprav vsebujejo na desetine različnih vrst celic, vsaka s svojimi edinstvenimi vzorci izražanja genov HIV.
"Obstaja velika raznolikost celic, tudi znotraj ene same linije," je dejal Collin Kieffer, docent za mikrobiologijo in avtor prispevka. "Spremenljivost odziva v teh rezervoarjih se poveča z vsako novo vrsto celice."
Alexandra Blanco, podiplomska študentka v Kiefferjevem laboratoriju, je želela preučiti tipe celic, ki so bile v tradicionalnih raziskavah virusa HIV spregledane. Z osredotočanjem na mieloidne celice je ustvarila knjižnico klonov, ki vsebuje 70 populacij latentno okuženih monocitov. Blanco je nato analiziral klonske populacije in njihove odzive na aktivacijo. Odzivi so se zelo razlikovali in poudarjali veliko raznolikost znotraj ene vrste celic.
To opazovanje odpira novo vprašanje: Ali različne vrste celic res kažejo različne odzive na zdravljenje z latenco HIV? Rezultati njihove študije so dejansko pokazali, da lahko nekateri terapevtiki za zakasnitev proti virusu HIV spodbujajo zakasnitev v celicah T in monocitih, medtem ko lahko v makrofagih obrnejo zakasnitev.
"Niso vse celice v telesu enake," je dejal Kieffer. "Torej je logično, da se vse okužene celice ne bodo odzvale na virus na enak način."
Njihov prispevek poudarja potrebo po prihodnjem zdravljenju virusa HIV, ki upošteva vse tipe celic in kako bi se vsaka celica lahko odzvala na možne terapije.
Njihove ugotovitve temeljijo na raziskavi Roya Dara, nekdanjega profesorja bioinženiringa v Illinoisu, katerega laboratorij je proučeval heterogenost v izražanju genov HIV.
"On je začel, mi pa smo ga prevzeli in pripeljali tja, kjer je zdaj," je dejal Kieffer. "Sodelovanje je torej resnično prineslo te rezultate. Obrnilo se je v novo smer za naš laboratorij in res smo navdušeni nad tem."
Dodatna in nepričakovana ugotovitev Blancove analize je razkrila spremembe v velikosti in obliki celic kot odgovor na okužbo, kar nakazuje, da lahko HIV spremeni morfologijo celic. Blancov naslednji cilj je določiti biološke mehanizme, na katerih temeljijo te fenotipske spremembe.
Kieffer in člani njegovega laboratorija se prav tako veselijo ponovitve svojih rezultatov, ki so bili večinoma narejeni na celični liniji, v primarnih celicah. Podvajanje rezultatov v modelu, ki je bolj podoben človeku, bi izboljšalo klinično pomembnost študije, je pojasnil Kieffer.
"Radi bi naredili večje zaslone v celicah T, monocitih in makrofagih, da bi prepoznali morebitna zdravila, ki bi lahko delovala v vseh teh tipih celic," je dejal Blanco. "Lahko bi našli še več molekul, ki se ne obnašajo na specifičen način celice."
