Novi genetski mehanizmi lahko zagotovijo terapevtske cilje proti gliomu
Zadnji pregled: 14.06.2024

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Raziskava iz laboratorija dr. Shi-Yuan Chenga, profesorja na oddelku za nevroonkologijo Ken in Ruth Davey na oddelku za nevrologijo, je odkrila nove mehanizme, na katerih temeljijo alternativni dogodki spajanja RNK v tumorskih celicah glioma, ki lahko služijo kot novih terapevtskih ciljev. Rezultati študije so objavljeni v Journal of Clinical Investigation.
"Našli smo drugačen način za zdravljenje glioma skozi objektiv alternativnega spajanja in odkrili nove tarče, ki prej niso bile identificirane, a so pomembne za malignost glioma,« je dejal Xiao Song, MD, PhD, izredni profesor nevrologije in glavni avtor študije.
Gliomi so najpogostejša vrsta primarnega možganskega tumorja pri odraslih in izvirajo iz glialnih celic, ki se nahajajo v centralnem živčnem sistemu in podpirajo bližnje nevrone. Gliomi so zelo odporni na standardna zdravljenja, vključno z obsevanjem in kemoterapijo, zaradi genetske in epigenetske heterogenosti tumorja, kar poudarja potrebo po iskanju novih terapevtskih ciljev.
Prejšnje študije laboratorija Cheng, objavljene v Cancer Research, so pokazale, da je pomemben faktor spajanja SRSF3 znatno povišan v gliomih v primerjavi z normalnimi možgani in da je SRSF3 reguliran Spajanje RNA spodbuja rast in napredovanje glioma z vplivanjem na številne celične procese v tumorskih celicah.
Spajanje RNK je proces, ki vključuje odstranitev intronov (nekodirajočih regij RNK) in združevanje eksonov (kodirajočih regij), da se tvori zrela molekula mRNK, ki podpira izražanje genov v celici.
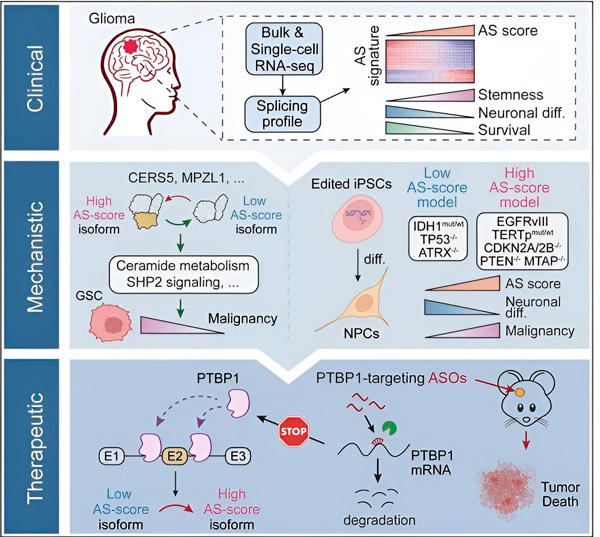
V tej študiji so se znanstveniki odločili identificirati spremembe v alternativnem spajanju tumorskih celic glioma, mehanizme, na katerih temeljijo te spremembe, in določiti njihov potencial kot terapevtske tarče.
Raziskovalci so z uporabo računalniških metod in tehnologij za določanje zaporedja RNK pregledali spremembe pri spajanju tumorskih celic glioma iz vzorcev bolnikov. Da bi potrdili te spremembe, so uporabili tehnologije za urejanje genov CRISPR, da bi uvedli različne gonilne mutacije glioma v modele glioma, ki izvirajo iz pluripotentnih matičnih celic (iPSC).
Ugotovili so, da so te spremembe spajanja okrepljene z različico receptorja epidermalnega rastnega faktorja III (EGFRIII), za katerega je znano, da je prekomerno izražen v številnih tumorjih, vključno z gliomi, in ga zavira mutacija v genu IDH1. p>
Raziskovalci so potrdili delovanje dveh dogodkov spajanja RNA, ki ustvarjata različne izooblike beljakovin z različnimi aminokislinskimi zaporedji.
"Samo ena od teh izooblik lahko spodbuja rast tumorja, v nasprotju z drugo izoobliko, ki se običajno izraža v normalnih možganih. Tumorji uporabljajo ta mehanizem za selektivno izražanje izooblike, ki spodbuja tumor, nad normalno izoformo možganov," Song rekel.
Ekipa je nato analizirala proteine, ki vežejo RNK navzgor, in ugotovila, da gen PTBP1 uravnava spajanje RNK, ki spodbuja tumor, v celicah glioma. Z uporabo ortotopnega imunsko pomanjkljivega mišjega modela glioma so raziskovalci ciljali na PTBP1 s terapijo s protismiselnimi oligonukleotidi (ASO), ki je na koncu zavrla rast tumorja.
"Naši podatki poudarjajo vlogo alternativnega spajanja RNA pri vplivanju na malignost in heterogenost glioma ter njegov potencial kot terapevtske ranljivosti za zdravljenje odraslih gliomov," so zapisali avtorji študije.
Naslednji načrt raziskovalcev je raziskati potencial ciljanja na PTBP1 za induciranje protitumorskega imunskega odziva, je dejal Song.
"Z analizo dolgo branja RNA-seq smo odkrili, da ciljanje na PTBP1 v celicah glioma povzroči proizvodnjo številnih alternativno spojenih transkriptov, ki jih v normalnih tkivih ni. Zato je naš naslednji projekt ugotoviti, ali lahko ta izoforma ustvari nekaj antigenov." tako da lahko imunski sistem bolje prepozna tumor,« je dejal Song.
Song je še dodala, da njeno ekipo zanima analiza sprememb pri spajanju netumorskih celic bolnikov z gliomom, kot so imunske celice.
»Vemo že, da je spajanje zelo pomembno za uravnavanje delovanja v celici, zato ne bi smelo le uravnavati malignosti tumorja, ampak lahko uravnava tudi delovanje imunskih celic, da ugotovi, ali lahko učinkovito ubijejo raka. Izvaja nekaj bioinformatičnih analiz v imunskih celicah, infiltriranih s tumorjem, da ugotovi, ali je prišlo do spremembe v spajanju, potem ko je imunska celica infiltrirala tumor.
"Naš cilj je določiti vlogo alternativnega spajanja pri oblikovanju mikrookolja tumorja, ki zavira imunski sistem, in prepoznati potencialne tarče za izboljšanje učinkovitosti imunoterapije pri gliomu," je dejal Song.
