Genska mutacija ARID1A naredi tumorje občutljive na imunoterapijo
Zadnji pregled: 14.06.2024

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Imunoterapija je v zadnjih letih spremenila zdravljenje raka. Namesto neposrednega ciljanja na tumorje, imunoterapija usmerja bolnikov imunski sistem, da učinkoviteje napada tumorje. To je še posebej učinkovito pri nekaterih vrstah raka, ki jih je težko zdraviti. Vendar se manj kot polovica vseh bolnikov z rakom odzove na sedanje imunoterapije, zaradi česar je nujno treba identificirati biomarkerje, ki lahko napovejo, katerim bolnikom bo zdravljenje najverjetneje koristilo.
Nedavno so znanstveniki opazili, da je bolj verjetno, da se bodo bolniki, katerih tumorji imajo mutacijo gena ARID1A, pozitivno odzvali na blokado imunske kontrolne točke, vrsto imunoterapije, ki deluje. Ohranjanje aktiviranih imunskih celic, ki se borijo proti raku.
Ker je mutacija gena ARID1A prisotna pri številnih oblikah raka, vključno z rakom endometrija, jajčnikov, debelega črevesa in danke, želodca, jeter in trebušne slinavke, so se raziskovalci inštituta Salk spraševali, kako bi lahko prispevala k občutljivosti zdravljenja in kako bi lahko kliniki uporabili te informacije za personalizacijo raka zdravljenje za vsakega bolnika.
Njihova nova študija, objavljena v žurnalu Cell, kaže, da mutacija ARID1A naredi tumorje občutljive na imunoterapijo, tako da v tumor prek imunskega odziva pridobi imunske celice, ki se borijo proti raku.. Podobno kot protivirusno.
Raziskovalci predlagajo, da bi lahko to mutacijo in protivirusni imunski odziv uporabili kot biomarker za boljšo izbiro bolnikov za specifične imunoterapije, kot je blokada imunske kontrolne točke. Ti rezultati spodbujajo tudi razvoj zdravil, ki ciljajo na ARID1A in z njim povezane beljakovine, da naredijo druge tumorje bolj občutljive na imunoterapijo.
»To bi lahko resnično spremenilo izid zdravljenja raka pri bolnikih,« pravi izredna profesorica Diana Hargreaves, višja avtorica študije. "Bolniki z mutacijo ARID1A že imajo imunski odziv, zato moramo le okrepiti ta odziv z blokado imunske kontrolne točke, da jim pomagamo uničiti tumorje od znotraj."
Čeprav je bilo znano, da se ljudje z mutacijami ARID1A dobro odzivajo na blokado imunske kontrolne točke, natančen odnos med obema ostaja nejasen. Da bi razjasnili mehanizem tega procesa, so znanstveniki z inštituta Salk uporabili mišje modele melanoma in kolorektalnega raka z mutacijo ARID1A in funkcionalno ARID1A.
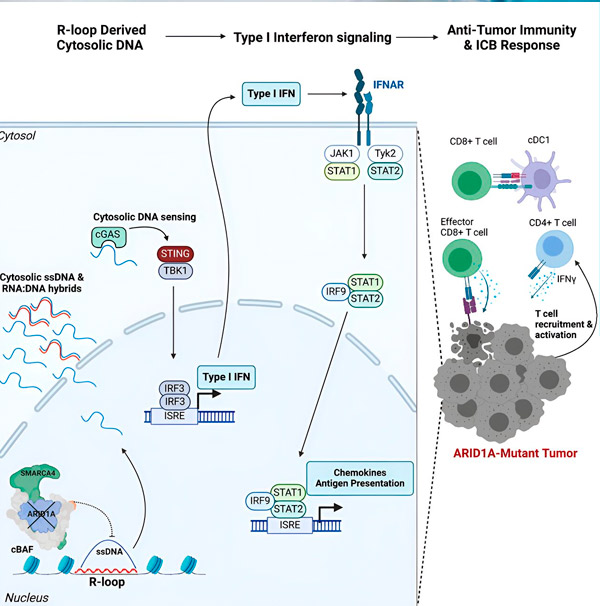
Vir: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Skupina je opazila močan imunski odziv pri vseh modelih z mutacijo ARID1A, vendar ne pri tistih, kjer je bil ARID1A funkcionalen, kar podpira idejo, da mutacija ARID1A dejansko spodbuja ta odziv. Kako pa deluje na molekularni ravni?
»Ugotovili smo, da ima ARID1A pomembno vlogo v jedru z ohranjanjem pravilne organizacije DNK,« pravi Matthew Maxwell, prvi avtor študije in podiplomski študent v laboratoriju Hargreaves. "Brez funkcionalnega ARID1A je mogoče prosto DNK izrezati in sprostiti v citosol, kar aktivira želeni protivirusni imunski odziv, ki ga je mogoče okrepiti z blokado imunske kontrolne točke."
Gen ARID1A kodira beljakovino, ki pomaga uravnavati obliko naše DNK in vzdrževati stabilnost genoma. Ko ARID1A mutira, se v rakavih celicah sproži veriga dogodkov, podobna stroju Rube Goldberg.
Na začetku odsotnost funkcionalnega ARID1A povzroči sproščanje DNK v citosol. Citosolna DNK nato aktivira protivirusni alarmni sistem, pot cGAS-STING, saj so naše celice prilagojene, da vsako DNK v citosolu označijo kot tujo, da se zaščitijo pred virusnimi okužbami. Končno pot cGAS-STING rekrutira imunski sistem, da rekrutira celice T v tumor in jih aktivira v specializirane celice T ubijalke raka.
Na vsakem koraku, odvisno od prejšnjega, ta veriga dogodkov – mutacija ARID1A, umik DNA, opozorilo cGAS-STING, rekrutacija celic T – povzroči povečanje števila celic T, ki se borijo proti raku, v tumorju. Blokado imunske kontrolne točke lahko nato uporabimo za zagotovitev, da te celice T ostanejo aktivirane, kar poveča njihovo sposobnost premagovanja raka.
"Naše ugotovitve zagotavljajo nov molekularni mehanizem, s katerim lahko mutacija ARID1A prispeva k protitumorskemu imunskemu odzivu," pravi Hargreaves. "Najbolj vznemirljiva stvar pri teh rezultatih je njihov translacijski potencial. Mutacije ARID1A lahko uporabimo za izbiro bolnikov za blokado imunske kontrolne točke in zdaj vidimo mehanizem, s katerim bi lahko zdravila, ki zavirajo ARID1A ali njegov proteinski kompleks, uporabili za nadaljnje izboljšanje imunoterapije pri drugih bolnikih."
Z opisom mehanizma, s katerim je blokada imunske kontrolne točke učinkovitejša pri raku z mutacijo ARID1A, raziskovalci kliničnim zdravnikom dajejo utemeljitev, da dajo prednost tej imunoterapiji za bolnike z mutacijo ARID1A. Ti rezultati predstavljajo pomemben korak pri prilagajanju zdravljenja raka in navdihujejo razvoj novih terapij, katerih cilj je zaviranje ARID1A in njegovega proteinskega kompleksa.
Ekipa inštituta Salk v prihodnosti upa, da bodo njihove ugotovitve izboljšale rezultate pri bolnikih z različnimi vrstami raka, povezanimi z mutacijami ARID1A, in namerava raziskati ta klinični prevod v sodelovanju s kalifornijsko univerzo v San Diegu. p>
