Medicinski strokovnjak članka
Nove publikacije
Eksperimentalni modeli osteoartritisa
Zadnji pregled: 07.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Hrustanec je visoko specializirano tkivo, ki vsebuje le eno vrsto celic (hondrocite) in je značilno po odsotnosti krvnih in limfnih žil. Hrustanec se prehranjuje predvsem z absorpcijo iz sinovialne tekočine. Presnovo hondrocitov uravnavajo številni topni faktorji, ki jih lokalno proizvajajo hondrociti in okoliška tkiva. Funkcija hondrocitov je odvisna tudi od sestave zunajceličnega okolja (napetost kisika, koncentracija ionov, pH itd.), sestave zunajceličnega matriksa, interakcije celic in matriksa ter fizikalnih signalov. Glavni cilj eksperimentalnega modeliranja je ustvariti kulture v zunajceličnem okolju brez spreminjanja fenotipa zrelih celic. Drugi cilj je ustvariti kulture za preučevanje prezgodnjega, zapoznelega, kratkotrajnega ali dolgotrajnega odziva hondrocitov na kemične in/ali fizikalne signale. Študije in vitro ponujajo tudi priložnost za preučevanje vedenja hondrocitov pri osteoartrozi. Tretji cilj je razviti sisteme kokultur, ki omogočajo preučevanje interakcij različnih tkiv v sklepu. Četrta naloga je priprava hrustančnih vsadkov za kasnejšo presaditev. In končno, peta naloga je preučevanje rastnih faktorjev, citokinov ali terapevtskih sredstev, ki so sposobna spodbuditi reparacijo in/ali zavirati resorpcijo hrustanca.
V zadnjih desetletjih so bili ustvarjeni različni modeli kultur sklepnih hrustančnih celic, vključno z enoslojnimi kulturami, suspendiranimi kulturami, hondronskimi kulturami, eksplantati, kokulturami in nesmrtnimi celičnimi kulturami. Vsaka kultura ima svoje prednosti in slabosti ter je primerna za preučevanje enega specifičnega vidika metabolizma hondrocitov. Tako so hrustančni eksplantati odličen model za preučevanje prometa elementov matriksa, kar zahteva pristne receptorje na celični površini in normalne interakcije med celicami, matriksom in matriksom, ter med celicami. Hkrati je priporočljivo preučevati depozite matriksa ali mehanizme, ki uravnavajo metabolizem hondrocitov, na kulturi izoliranih celic. Za preučevanje procesa diferenciacije celic je potrebna enoslojna kultura z nizko gostoto. Kulture, suspendirane v naravnem ali sintetičnem matriksu, so model za analizo prilagoditvenega odziva hondrocitov na mehanski stres.
Kulture hondrocitov
Pri izbiri hrustančnega tkiva za študije in vitro je treba upoštevati več pomembnih točk. Sestava matriksa in presnovna aktivnost hondrocitov se med sklepi razlikujeta, slednja pa je odvisna tudi od globine lokacije hondrocitov v tkivu. Ti podatki so bili pridobljeni v več poskusih, v katerih so preučevali izolirane subpopulacije hondrocitov iz hrustančnih con različnih globin. Ugotovljene so bile številne morfološke in biokemične razlike med gojenimi hondrociti, ki se nahajajo v površinskih in globokih plasteh sklepnega hrustanca. Površinske celice sintetizirajo redek, s proteoglikani reven fibrilarni matriks, medtem ko globlje celice proizvajajo matriks, bogat s fibrili in proteoglikani. Poleg tega površinske celice proizvajajo relativno več majhnih neagregiranih proteoglikanov in hialuronske kisline ter relativno manj agrekana in keratan sulfata kot globlje ležeči hondrociti. Druga pomembna značilnost presnove hondrocitov, izoliranih iz hrustančnih con različnih globin, je odziv na eksogeni dražljaj. Po mnenju M. Aydelotte in sod. so bili goveji hondrociti iz površinske cone hrustanca bolj občutljivi na IL-1 kot celice iz globoke cone.
Obnašanje celic je odvisno tudi od lokacije tkiva. Hondrociti iz hrustanca reber in ušes iste živali se različno odzivajo na rastne faktorje, kot sta fibroblastni rastni faktor (FGF) in TGF-beta. FGF je povečal vgradnjo timidina, prolina in levcina v gojena rebra, ne pa tudi v hondrocite ušesa. TGF-beta je povečal vgradnjo timidina v hondrocite hrustanca reber in ušesa, vendar ni vplival na vgradnjo timidina in prolina v hondrocite ušesa. Hrustančne celice z območij z visoko obremenitvijo se razlikujejo od tistih z območij z nizko obremenitvijo hrustanca. Tako hondrociti zrelega hrustanca kolenskega sklepa ovc iz osrednjega območja sklepne površine golenice, ki ga ne pokriva meniskus, ki in vivo nosi največjo obremenitev, sintetizirajo manj agrekana, vendar več dekorina kot celice iz con, ki jih pokriva meniskus. Avtorji poudarjajo tudi pomen uporabe hrustanca iz identičnih sklepnih con pri preučevanju sintetične funkcije sklepov.
Presnova hondrocitov in njihov odziv na regulatorne dejavnike sta pomembno odvisna tudi od starosti darovalca, njegovega razvoja skeleta in stanja sklepov, iz katerih so celice odvzete. Pri človeških hondrocitih opazimo znatno zmanjšanje proliferativnega odziva s starostjo. Največje zmanjšanje opazimo pri darovalcih, starih 40–50 let in nad 60 let. Poleg tega se s staranjem zmanjšuje resnost proliferativnega odziva na rastne faktorje (npr. FGF in TGF-beta). Poleg kvantitativnih sprememb v proliferaciji hondrocitov se pojavljajo tudi kvalitativne spremembe. Celice mladih darovalcev (10–20 let) se bolje odzivajo na rastni faktor, pridobljen iz trombocitov (PDGF), kot na TGF-beta, medtem ko je pri celicah odraslih darovalcev opaziti nasprotno. Za razlago starostno odvisnih sprememb v sintetični funkciji hondrocitov in njihovega odziva na rastne faktorje se uporablja več mehanizmov. Mednje spadajo zmanjšanje števila in afinitete receptorjev površinskih celic, spremembe v sintezi in bioaktivnosti rastnih faktorjev in citokinov ter modifikacija post-receptorskih signalov.
Patološko stanje sklepov spreminja tudi morfologijo in presnovno aktivnost hondrocitov. Tako so J. Kouri in sodelavci (1996) v hrustancu pri osteoartrozi identificirali tri subpopulacije hondrocitov. Hondrociti iz površinskega in zgornjega dela srednjega hrustanca tvorijo grozde in sintetizirajo večjo količino proteoglikanov in kolagena. TGF-beta in inzulinu podoben rastni faktor (IGF) lahko stimulirata sintezo proteoglikanov s strani hondrocitov in delno nevtralizirata učinke IL-1 in TNF-a. Eksplantati hrustanca, ki jih je prizadela osteoartroza, in hondrociti, izolirani iz hrustanca bolnika z osteoartrozo, so bolj občutljivi na stimulacijo TGF-beta kot hondrociti zdravega hrustanca. Te razlike so najverjetneje povezane s fenotipskimi spremembami hondrocitov v zgornjih plasteh sklepnega hrustanca.
Izolacijo posameznih hondrocitov dosežemo z zaporedno obdelavo zunajcelične mase (ECM) s proteolitičnimi encimi. Po sprostitvi iz ECM so izolirane celice idealne za preučevanje de novo sinteze komponent matriksa. Nekateri avtorji uporabljajo samo klostridijsko kolagenazo, drugi pa hrustanec predhodno inkubirajo s tripsinom, pronazo, DNazo in/ali hialuronidazo. Število izoliranih celic je odvisno od uporabljenih encimov. Tako lahko pri obdelavi samo s kolagenazo iz 1 g tkiva dobimo 1,4–10⁶ hondrocitov, pri uporabi pronaze, hialuronidaze in kolagenaze pa 4,3–10⁶ .Pri obdelavi s kolagenazo ostanejo agrekan, beljakovine, IL-6 in IL-8 v celični kulturi v bistveno večjih količinah kot pri zaporedni obdelavi z različnimi encimi. Za te razlike med obema celičnima kulturama obstaja več razlag:
- Encimi poškodujejo ali zavirajo celične receptorje, TGF-beta zavira sintezo DNK in proteoglikanov v sveže izoliranih hondrocitih (1. dan), medtem ko TGF-beta stimulira sintezo DNK in proteoglikanov v hondrocitih, gojenih v monosloji (7 dni). Vendar pa je pred začetkom poskusa potrebno ustrezno obdobje za ponovno izražanje teh membranskih komponent.
- Eksogene proteaze lahko motijo interakcijo med celico in matriksom, ki jo posreduje integrin. Družina integrinov spodbuja vezavo hondrocitov na molekule zunajcelične matrike (Shakibaei M. et al., 1997). Ta motnja lahko vpliva na izražanje genov matriksa.
- Ostanki komponent matriksa lahko uravnavajo sintetično funkcijo hondrocitov. Integrini so sposobni prepoznati produkte razgradnje zunajcelične mase (ECM) in tako igrajo pomembno vlogo pri popravljanju tkiva po delovanju proteolitičnih encimov. T. Larsson in sod. (1989) so poročali, da dodatek intaktnih ali fragmentiranih proteoglikanov celični kulturi spodbuja sintezo beljakovin in proteoglikanov. Vendar pa visoka raven hialuronske kisline povzroči znatno zmanjšanje vključitve sulfatov v sintezo proteoglikanov s strani hondrocitov piščančjega zarodka, zrelih hondrocitov prašičjih in podganjih celic hondrosarkoma. Poleg tega je hialuronska kislina zaviralec sproščanja proteoglikanov iz celic tudi v prisotnosti IL-1b, TNF-a, FGF, kar kaže na zaviranje prve biološke aktivnosti rastnih faktorjev in citokinov. Natančen mehanizem delovanja hialuronske kisline ostaja nejasen; znano je, da hondrociti vsebujejo receptor za hialuronsko kislino, povezan z aktinskimi filamenti citosola. Vezava hialuronske kisline na njen receptor spodbuja fosforilacijo beljakovin. Ti podatki torej kažejo na modulacijo presnovne funkcije hondrocitov s fragmentiranimi ali nativnimi molekulami matričnih proteinov z aktivacijo receptorjev celične membrane.
- Hitra stimulacija sinteze matričnih beljakovin s strani hondrocitov z encimi je lahko posledica sprememb v obliki hondrocitov in/ali reorganizacije citoskeleta.
- Nekateri citokini (npr. IL-8) in rastni faktorji (npr. IGF-1, TGF-β) so sekvestrirani v zunajcelični matrici (ECM). Najbolj znan primer je vezava TGF-β z dekorinom, kar povzroči zmanjšano sposobnost prvega, da inducira rast celic v celicah jajčnikov kitajskega hrčka. Ugotovitev, da se vsebnost dekorina v hrustancu s starostjo povečuje, kaže na zmanjšanje biološke uporabnosti TGF-β s staranjem. Rastni faktorji in citokini se lahko med kulturo sproščajo iz ostankov matriksa in posledično modulirajo delovanje hondrocitov.
Monoslojna kultura hondrocitov
Diferencirani fenotip hondrocitov je v prvi vrsti značilen po sintezi kolagena tipa II in tkivno specifičnih proteoglikanov ter nizki ravni mitotične aktivnosti. Obstajajo dokazi, da pri dolgotrajni celični kultivaciji v monosloju, pa tudi po več ponovljenih celičnih pasažah, hondrociti izgubijo svoje sferične obrise in pridobijo podolgovato, fibroblastom podobno obliko. Pri takšni fibroblastni metaplaziji se spremeni tudi sintetična funkcija celic, za katero je značilno progresivno zmanjšanje sinteze kolagenov tipov II, IX in XI ter povečanje sinteze kolagenov tipov I, III in Y. Zaradi funkcionalnega agrekana se sintetizirajo majhni neagregirani proteoglikani. Sinteza katepsina B in L je v diferenciranih celicah izjemno nizka, vendar se poveča v procesu izgube diferenciacije. Kolagenaza-1 se izraža v diferenciranih hondrocitih; pri dolgotrajni kultivaciji se njena ekspresija zmanjša, medtem ko se poveča proizvodnja tkivnih inhibitorjev metaloproteinaz (TIMP).
Diferencirani hondrociti ponovno izražajo kolagen diferenciranega fenotipa, ko so preneseni iz enoslojne v suspendirano kulturo. Proces diferenciacije je verjetno povezan z obliko celic. To lastnost redno uporabljajo raziskovalci, ki preučujejo okvarjene presadke z avtolognimi hondrociti. Majhno število celic, pridobljenih iz biopsijskega materiala, je mogoče razširiti v enoslojni kulturi in nato pred presaditvijo ponovno vnesti v tridimenzionalno matrico. Ponovno izražanje specifičnega fenotipa z dediferenciranimi hondrociti, prenesenimi v agarozno kulturo, lahko stimulirajo TGF-β, ossein-hidroksiapatitni kompleks in askorbinska kislina.
Kot odziv na rastne faktorje in citokine se hondrociti med procesom diferenciacije modificirajo. Celični odziv na citokine in rastne faktorje se razlikuje med nediferenciranimi in diferenciranimi hondrociti. IL-1 spodbuja proliferacijo fibroblastov, medtem ko IL-1 zavira rast nediferenciranih hondrocitov. IGF-1 spodbuja sintezo DNK v podolgovatih, a ne sploščenih hondrocitih. V diferenciranih hondrocitih so stimulativni učinki IL-1beta in TNF-a na proizvodnjo prokolagenaze bolj izraziti kot v nediferenciranih hondrocitih.
Gojenje hondrocitov
Gojenje hondrocitov v suspenziji v tekočem mediju ali v naravnem ali sintetičnem tridimenzionalnem matriksu stabilizira fenotip hondrocitov. Celice ohranijo svojo sferično obliko in sintetizirajo tkivno specifične beljakovine. Suspendirana kultura hondrocitov se običajno priporoča za preučevanje nastanka novega pericelularnega matriksa. Kulture hondrocitov v sintetičnih ali naravnih absorpcijskih polimerih se uporabljajo za implantacijo celic v hrustančne defekte za spodbujanje regeneracije sklepnega hrustančnega tkiva. Sintetični ali naravni medij za vsajene celice mora izpolnjevati številne zahteve:
- vsadki morajo imeti porozno strukturo za adhezijo in rast celic,
- niti polimer sam niti njegovi razgradni produkti ne smejo povzročati vnetja ali toksičnih reakcij pri implantaciji in vivo,
- Nosilec presadka se mora imeti sposobnost vezave na sosednji hrustanec ali subhondralno kost,
- naravna ali sintetična matrica mora imeti sposobnost absorpcije, njeno razgradnjo pa mora uravnotežiti regeneracija tkiva,
- Za lažjo obnovo hrustanca morata kemijska struktura in arhitektura por matriksa omogočati vzdrževanje celičnega fenotipa in sintezo tkivno specifičnih beljakovin s strani hondrocitov, ki so v njem nameščeni,
- Med implantacijo in vivo je treba preučiti mehanske lastnosti sintetične ali naravne matrice.
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Suspenzija hondrocitov v tekoči fazi
Pritrditev celic na plastične posode, v katerih gojimo hondrocite, lahko preprečimo s premazom njihovih sten z raztopino metilceluloze, agaroze, hidrogela (poli-2-hidroksietil metakrilata) ali mešanice kolagena in agaroze. V teh pogojih hondrociti tvorijo grozde in sintetizirajo predvsem agrekane in tkivno specifične kolagene (tipi II, IX, XI). Običajno najdemo dve vrsti celic. Celice, ki se nahajajo v središču, ohranijo kroglasto obliko in so obdane z dobro razvitim zunajceličnim matrikom (ECM), kar potrjujejo histokemične in ultrastrukturne študije. Na periferiji imajo hondrociti diskoidne obrise in so obdane z redkim ECM; o funkcionalnih značilnostih takšnih celic je znanega malo.
Hondrocite je mogoče gojiti na mikronosilcih, ki se vzdržujejo v suspenziji; kot mikronosilci se uporabljajo dekstranske kroglice (cytodex), s kolagenom prevlečene dekstranske kroglice (cytodex III) in neporozne mikrosfere kolagena tipa I (cellagen). V teh pogojih gojenja se hondrociti pritrdijo na površino mikronosilcev, ohranijo svojo sferično obliko in tvorijo material, podoben matriksu. Poleg tega uporaba cellagena spodbuja proliferacijo hondrocitov in ponovno izražanje normalnega fenotipa. Zato se lahko gojenje hondrocitov na mikrosferah cellagena uporabi za obnovitev celičnega fenotipa pred presaditvijo.
Druga metoda gojenja suspenzije hondrocitov v tekočem mediju je njihovo gojenje v obliki gostih kroglic, sestavljenih iz celic (0,5-1 * 10 b ), pridobljenih s centrifugiranjem. Takšni hondrociti so sposobni proizvajati matrico, ki vsebuje veliko količino proteoglikanov, kolagena tipa II, ne pa tudi kolagena tipa I, kar potrjujejo histološke, imunohistokemične in kvantitativne metode.
Suspenzija hondrocitov v naravnem ECM
Hondrocite lahko gojimo v suspenziji v tridimenzionalni matrici (mehki agar, agaroza, kolageni gel ali goba, hialuronska kislina, fibrinsko lepilo, alginatne kroglice).
Hondrociti, gojeni v agarozi, ohranijo svoj normalni fenotip in sintetizirajo kolagen tipa II ter tkivno specifične agregate agrekanov. Pri gojenju v agarozi se proteoglikani, ki jih sintetizira celica, sproščajo v medij 50 dni. Za primerjavo, pri monoslojni kulturi je celična faza že v prvih 5-6 dneh gojenja prenapolnjena z glikozaminoglikani; pri gojenju v gojišču po povečani sintezi in sproščanju glikozaminoglikanov v prvih 8-10 dneh pride do njihovega časovno odvisnega zmanjšanja. Kljub temu se vedenje hondrocitov pri gojenju v agarozi razlikuje od obnašanja in vivo. V agarozi veliko število sintetiziranih agregatov agrekanov vsebuje manjše molekule in manj molekul kot in vivo. TGF-β spodbuja sintezo proteoglikanov v eksplantatu, vendar zmanjša sintezo agrekanov v agarozi.
Alginat je linearni polisaharid, pridobljen iz rjavih morskih alg. V prisotnosti dvovalentnih kationov, kot so ioni Ca2 +, ta polimer postane gel. Vsak hondrocit, ujet v alginatu, je obdan z matrico negativno nabitih polisaharidov, katerih pore so primerljive s tistimi v hialinskem hrustancu. Matrica, ki jo tvorijo hondrociti v alginatnih kroglicah, je sestavljena iz dveh predelkov - tanke plasti celično povezane matrike, ki ustreza pericelularni in teritorialni matriki sklepnega hrustanca, in bolj oddaljene matrike, ki je enakovredna interteritorialni v nativnem tkivu. Na 30. dan gojenja sta relativna in absolutna prostornina, ki jo zasedajo celice in vsak od obeh predelkov v alginatni kroglici, skoraj popolnoma enaka tistim v nativnem hrustancu. Skoraj 30 dni hondrociti ohranijo svojo sferično obliko in proizvajajo agrekan, katerega hidrodinamične lastnosti so podobne lastnostim molekul agrekana v matriksu sklepnega hrustanca, pa tudi molekul kolagena tipov II, IX in XI. Hkrati so na površini alginatnih kroglic, tako kot pri drugih suspenzijskih kulturah, prisotne sploščene celice, ki proizvajajo majhno količino kolagenskih molekul tipa I, ki se neposredno sproščajo v medij in se ne vgrajujejo v zunajcelični material (ECM). V alginatnih kroglicah opazimo zmerno proliferacijo hondrocitov. Po 8 mesecih gojenja v alginatnem gelu zreli hondrociti ne izgubijo presnovne aktivnosti in še naprej sintetizirajo tkivno specifični kolagen tipa II in agrekan.
H. Tanaka in sodelavci (1984) so raziskovali difuzijske lastnosti različnih naravnih molekul v alginatu in ugotovili, da molekule, večje od 70 kDa, niso difundirale skozi alginat. Zato je celična kultura v alginatu primerna za preučevanje regulacije biosinteze matriksa in organizacije zunajcelične matrike (ECM). Razpoložljivost celic, gojenih v alginatu, omogoča preučevanje delovanja peptidnih regulatornih faktorjev in farmakoloških sredstev na transkripcijski, posttranskripcijski in translacijski ravni.
Hondrocite gojimo tudi v matriksu kolagenskih vlaken tipov I in II. S. Nehrer in sod. (1997) so primerjali delovanje pasjih hondrocitov v poroznih polimernih matriksih kolagena in proteoglikana, ki vsebujejo kolagene različnih tipov. Ugotovili so pomembne razlike v morfologiji biosintetske funkcije hondrocitov, gojenih v kolagenskih matriksih, ki vsebujejo kolagene tipov I in II. Celice v matriksu kolagena tipa II so ohranile svojo sferično obliko, medtem ko so imele v kolagenu tipa I morfologijo, podobno fibroblastom. Poleg tega so v matriksu kolagena tipa II hondrociti proizvedli večjo količino glikozaminoglikanov. J. van Susante in sod. (1995) so primerjali lastnosti hondrocitov, gojenih v alginatnem in kolagenskem (tip I) gelu. Avtorji so ugotovili znatno povečanje števila celic v kolagenskem gelu, vendar so od 6. dneva gojenja celice izgubile svoj značilni fenotip in se spremenile v celice, podobne fibroblastom. V alginatnem gelu so opazili zmanjšanje števila celic, vendar so hondrociti ohranili svoj normalni fenotip. V kolagenskem gelu je bilo število proteoglikanov na celico bistveno večje kot v alginatu, vendar je bilo v gelu opaženo zmanjšanje sinteze matričnih elementov, začenši od 6. dneva gojenja, medtem ko se je v alginatu sinteza še naprej povečevala.
Trdna tridimenzionalna fibrinska matrica je naravna snov, ki podpira hondrocite, suspendirane v njej, v diferenciranem fenotipu. Tridimenzionalna fibrinska matrica se lahko uporablja tudi kot nosilec pri presaditvi hondrocitov. Prednosti fibrina so odsotnost citotoksičnosti, sposobnost zapolnjevanja prostora in adhezivna sposobnost. Histološke in biokemijske študije, avtoradiografija in elektronska mikroskopija so pokazale, da hondrociti v fibrinskem gelu ohranijo svojo morfologijo, proliferirajo in proizvajajo matrico tudi po 2 tednih gojenja. Vendar pa so G. Homminga in sod. (1993) poročali, da se razgradnja fibrina začne po 3 dneh gojenja in da dediferenciacija hondrocitov napreduje.
Suspenzija hondrocitov v umetnem (sintetičnem) ECM
Hrustančne vsadke za rekonstruktivno ali ortopedsko kirurgijo je mogoče dobiti z gojenjem izoliranih hondrocitov in vitro v sintetični biokompatibilni matrici.
Hondrociti, gojeni v poliglikolni kislini, proliferirajo in ohranjajo normalno morfologijo in fenotip 8 tednov. Kompleks hondrocitov in poliglikolne kisline je sestavljen iz celic, glikozaminoglikanov, kolagena in ima zunanjo kolageno kapsulo. Vendar takšni vsadki vsebujejo dve vrsti molekul kolagena - I in II. Vsadki iz hondrocitov, dediferenciranih z vrsto pasaž, imajo večjo količino glikozaminoglikanov in kolagena kot vsadki iz primarno nediferenciranih hondrocitov.
L. Freed in sodelavci (1993b) so primerjali obnašanje kultur človeških in govejih hondrocitov v vlaknasti poliglikolni kislini (FPGA) in porozni polimlečni kislini (PPLA). Po 6–8 tednih gojenja govejih hondrocitov v FPGA ali PPLA so avtorji opazovali proliferacijo celic in regeneracijo hrustančnega matriksa. V FPGA so imeli hondrociti kroglasto obliko in so se nahajali v lakunah, obdanih s hrustančnim matriksom. Po 8 tednih gojenja in vitro je regenerirano tkivo vsebovalo do 50 % suhe snovi (4 % celične mase, 15 % glikozaminoglikanov in 31 % kolagena). V PPLA so imele celice vretenasto obliko in majhno količino glikozaminoglikanov in kolagena. V FPGA je bila rast celic 2-krat intenzivnejša kot v PPLA. In vivo so hondrociti, gojeni v VPGK in PPLC, v 1–6 mesecih proizvedli tkivo, histološko podobno hrustancu. Vsadki so vsebovali glikozaminoglikane, kolagena tipa I in II.
Goveje fetalne hondrocite smo gojili v poroznem hidrofobnem in hidrofilnem polietilenu visoke gostote. Po 7 dneh inkubacije v obeh substratih so celice ohranile kroglasto obliko in vsebovale predvsem kolagen tipa II. Po 21 dneh gojenja so ugotovili, da hidrofilni matriks vsebuje več kolagena tipa II kot hidrofobni matriks.
Hrustančno tkivo lahko pridobimo tudi z gojenjem v monosloju na filtrih Millicell-CM. Za pritrditev hondroitinov je potrebna predhodna prevleka filtrov s kolagenom. Histološka preiskava kulture dokazuje kopičenje hondrocitov v zunajceličnem hrustancu (ECM), ki vsebujejo proteoglikane in kolagen tipa II. Kolagen tipa I v takšni kulturi ni bil zaznan. Hondrociti v pridobljenem hrustančnem tkivu so okrogle oblike, na površini tkiva pa so nekoliko sploščeni. Debelina novo nastalega tkiva se je sčasoma povečevala in je bila odvisna od začetne gostote celičnega monosloja. V optimalnih pogojih gojenja je debelina hrustančnega tkiva dosegla 110 μm, organizacija njegovih celic in kolagena v površinske in globoke plasti pa je podobna kot v sklepnem hrustancu. Zunanjecelični hrustanec vsebuje približno 3-krat več kolagena in proteoglikanov. Po 2 tednih gojenja so opazili kopičenje matriksa, kar je omogočilo ekstrakcijo tkiva iz filtra in njegovo uporabo za presaditev.
Sims in sodelavci (1996) so preučevali gojenje hondrocitov v polietilen oksidnem gelu, enkapsulirani polimerni matrici, ki omogoča prenos velikega števila celic z injekcijo. Šest tednov po injekciji v podkožno tkivo atimičnih miši je nastal nov hrustanec, ki je bil morfološko značilen po beli opalescenci, podobni hialinskemu hrustancu. Histološki in biokemični podatki so pokazali prisotnost aktivno proliferirajočih hondrocitov, ki proizvajajo zunajcelični hrustanec (ECM).
Razlaga
Eksplantacija hrustančnega tkiva se uporablja za preučevanje procesov ana- in katabolizma v njem, vzdrževanja homeostaze, resorpcije in popravljanja. Hondrociti v eksplantih hrustanca ohranjajo normalen fenotip in sestavo zunajcelične mase (ECM), podobno tistim v sklepnem hrustancu in vivo. Po 5 dneh gojenja v prisotnosti seruma se doseže konstantna raven sinteze in naravnih procesov razgradnje. Resorpcijo tkiva je mogoče pospešiti v glavni kulturi in v kulturi z dodatkom seruma z uporabo številnih sredstev, kot so IL-IB, TNF-a, bakterijski lipopolisaharidi, derivati retinojske kisline ali aktivni kisikovi radikali. Za preučevanje popravljanja hrustanca se njegova poškodba povzroči s topnimi vnetnimi mediatorji (H2O2, IL 1, TNF-a) ali fizično rupturo matriksa.
Metoda organotipske kulture je model za in vitro študije učinkov izoliranih zunanjih dejavnikov na hondrocite in okoliški matriks. In vivo so hondrociti redko razporejeni v zunajceličnem matriksu in se ne stikajo med seboj. Kultura eksplantata sklepnega hrustanca ohranja to strukturno organizacijo, kot tudi specifične interakcije med hondrociti in okoliškim zunajceličnim okoljem. Ta model se uporablja tudi za preučevanje učinkov mehanskega stresa, farmakoloških učinkovin, rastnih faktorjev, citokinov in hormonov na presnovo hrustanca.
Druga prednost eksplantacije hrustančnega tkiva je odsotnost poškodb hondrocitov pod vplivom proteolitičnih encimov ali mehanskih dejavnikov, kar je neizogibno pri izolaciji celic. Receptorji in drugi membranski proteini ter glikoproteini so zaščiteni pred škodljivimi dejavniki.
 [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Hondronska kultura
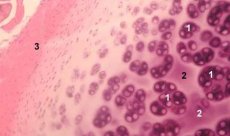
Hondron je strukturna, funkcionalna in presnovna enota sklepnega hrustanca, ki jo sestavljajo hondrocit, njegov pericelularni matriks in kompaktna nitasta kapsula ter je odgovorna za homeostazo matriksa. Hondroni se mehansko ekstrahirajo iz hrustanca in zberejo z več zaporednimi homogenizacijami pri nizki hitrosti. Hondrone, izolirane iz con različnih globin hrustanca, lahko razdelimo v štiri kategorije: posamezni hondron, parni hondroni, več (trije ali več) linearno razporejenih hondronov (stolpci hondronov) in skupki hondronov.
Posamezni hondroni se običajno nahajajo v srednjih plasteh intaktnega hrustanca, parni hondroni se nahajajo na meji med srednjo in globoko plastjo, linearno razporejeni večkratni hondroni pa so značilni za globoke plasti intaktnega hrustanca. Končno, grozdi hondronov so sestavljeni iz naključno organiziranih skupin posameznih in parnih hondronov, ki po homogenizaciji ohranijo agregirano stanje. Grozdi hondronov so veliki fragmenti hrustanca, ki običajno vsebujejo več hondronov in radialno razporejene kolagene fibrile, tj. tipično organizacijo, značilno za globoke plasti matriksa. Hondroni so imobilizirani v prozorni agarozi, kar omogoča preučevanje njihove strukture, molekularne sestave in presnovne aktivnosti. Sistem hondronov-agaroze velja za mikromodel hrustanca, ki se od tradicionalnega sistema hondrocitov-agaroze razlikuje po tem, da je ohranjeno naravno mikrookolje in ga ni treba sintetizirati in sestavljati. Kultura hondronov je model za preučevanje interakcij celic in matriksa v sklepnem hrustancu v normalnih in patoloških pogojih.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Kultura nesmrtnih hondrocitov
Za ustvarjanje trajnih celičnih linij se uporablja rekombinantna DNK ali virusi, ki vsebujejo onkogen in so sposobni celico narediti "nesmrtno". Nesmrtni hondrociti se lahko neskončno razmnožujejo, hkrati pa ohranjajo stabilen fenotip. F. Mallein-Gerin in sodelavci (1995) so pokazali, da onkogen SV40T povzroča proliferacijo mišjih hondrocitov, ki še naprej stabilno izražajo kolagen tipa II, IX in XI, pa tudi sklepni agrekan in vezavno beljakovino. Vendar pa takšna celična linija pridobi sposobnost sinteze kolagena tipa I, ko jo gojimo v enoslojni kulturi ali v agaroznem gelu.
W. Horton in sodelavci (1988) so opisali linijo nesmrtnih celic z nizko stopnjo izražanja mRNA kolagena tipa II. Te celice so bile pridobljene z njihovo transformacijo z mišjim retrovirusom, ki vsebuje onkogene I-myc- in y-ra. Ta vrsta celic predstavlja edinstven model za preučevanje interakcij sklepnega matriksa v odsotnosti kolagena tipa II, kot tudi za regulacijo sinteze kolagena tipa II.
Kultura hondropritov z mutiranimi ali izbrisanimi geni je priročen model za preučevanje njihove fiziološke funkcije. Ta model je še posebej primeren za preučevanje vloge specifičnih molekul pri organizaciji hrustančnega matriksa ali za preučevanje učinkov različnih regulatornih dejavnikov na presnovo hrustanca. Hondrociti z izbrisanim genom za kolagen tipa IX sintetizirajo kolagenske fibrile, ki so širše od normalnih, kar kaže na to, da kolagen tipa IX uravnava premer fibril. Kot je navedeno v 1. poglavju, je bila nedavno v družinah s primarno generalizirano osteoartritisom odkrita mutacija v genu COLAI, ki kodira kolagen tipa II. Za preučevanje učinka mutantnega kolagena tipa II na sklepni matriks so R. Dharmrvaram in sod. (1997) in vitro transficirali (okužili s tujo nukleinsko kislino) okvarjen COL 2 AI (arginin na položaju 519 je nadomeščen s cisteinom) v človeške fetalne hondrocite.
Sistem kokulture. V sklepu hrustanec interagira z drugimi vrstami celic, ki jih vsebujejo sinovialna membrana, sinovialna tekočina, vezi in subhondralna kost. Na presnovo hondrocitov lahko vplivajo različni topni dejavniki, ki jih sintetizirajo naštete celice. Tako pri artritisu sklepni hrustanec uničujejo proteolitični encimi in prosti radikali, ki jih proizvajajo sinovialne celice. Zato so bili razviti modeli za preučevanje kompleksnih interakcij med hrustancem in okoliškimi tkivi, ki jih imenujemo kokulture.
S. Lacombe-Gleise in sodelavci (1995) so gojili kunčje hondrocite in osteoblaste v sistemu kokulture (COSTAR), v katerem so bile celice ločene z mikroporozno membrano (0,4 μm), kar je omogočalo izmenjavo med obema tipoma celic brez neposrednih stikov. Ta študija je pokazala sposobnost osteoblastov, da spodbujajo rast hondrocitov prek topnih mediatorjev.
AM Malfait in soavtorji (1994) so preučevali odnos med monociti v periferni krvi in hondrociti. Ta model je primeren za preučevanje procesov, ki jih posredujejo citokini, pri vnetnih artropatijah (revmatoidni artritis, seronegativni spondiloartritisi itd.). Avtorji modela so celice ločili z membrano, ki veže beljakovine, s porami premera 0,4 μm. Študija je pokazala, da monociti, stimulirani z lipopolisaharidom, proizvajajo IL-1 in TNF-a, ki zavirata sintezo agrekana s strani hondrocitov in prispevata k razgradnji že sintetiziranih agregatov agrekana.
K. Tada in sodelavci (1994) so ustvarili model kokulture, v katerem so bile endotelijske celice v kolagenskem (tip I) gelu nameščene v notranjo komoro, ločeno od zunanje komore, v katero so bili nameščeni hondrociti s filtrom z velikostjo por 0,4 μm. V stanju popolne izolacije od zunanje komore so človeške endotelijske celice v prisotnosti EGF ali TGF-α tvorile cevke v kolagenskem gelu. Ko sta bili obe vrsti celic gojeni hkrati, je bila tvorba cevk, odvisna od TGF-α, s strani endotelijskih celic zavrta. Inhibicijo tega procesa s strani hondrocitov so delno odpravila protitelesa proti TGF-beta. Lahko se domneva, da TGF-beta, ki ga proizvajajo hondrociti, zavira vaskularizacijo samega hrustanca.
S. Groot in sodelavci (1994) so hkrati gojili hondrocite iz hipertrofičnih in proliferativnih con kosti 16 dni starega mišjega zarodka s koščki možganskega tkiva. Po 4 dneh gojenja so opazili transdiferenciacijo hondrocitov v osteoblaste in začetek nastajanja osteoidov. Po 11 dneh gojenja je bil del hrustanca nadomeščen s kostnim tkivom, kostna matrica pa je bila delno kalcificirana. Nekateri nevropeptidi in nevrotransmiterji, ki jih proizvaja možgansko tkivo, vplivajo na presnovo osteoblastov ali imajo zanje receptorje. Med njimi so norepinefrin, vazoaktivni črevesni peptid, peptid, povezan z genom kalcitonina, snov P in somatostatin. Koščki možganskega tkiva, gojeni skupaj s hondrociti, lahko proizvajajo nekatere od naštetih dejavnikov, ki lahko sprožijo proces transdiferenciacije hondrocitov v osteoblaste.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Vpliv zunanjih dejavnikov na kulturo hondrocitov
Vpliv napetosti kisika na presnovo hondrocitov
V večini primerov se kulture hondrocitov razvijajo v pogojih atmosferskega tlaka kisika. Vendar pa je dobro znano, da hondrociti in vivo obstajajo v hipoksičnih pogojih in da se tlak kisika spreminja v različnih patoloških pogojih. Med procesom zorenja opazimo pomembne spremembe v prekrvavitvi epifiz. Ker se vaskularizacija razlikuje v različnih conah rastne plošče, se spreminja tudi tlak kisika v njih. C. Brighton in R. Heppenstall (1971) sta dokazala, da je v tibialni plošči kuncev tlak kisika v hipertrofični coni nižji kot v okoliškem hrustancu. Meritve nekaterih presnovnih parametrov so pokazale, da se hondrociti lahko hitro odzovejo na lokalne spremembe koncentracije kisika. Najprej se pri nizkem tlaku kisika zmanjša njegova poraba s strani hondrocitov. Z zmanjšanjem tlaka kisika z 21 na 0,04 % se poveča izkoriščanje glukoze, poveča se aktivnost glikolitičnih encimov in sinteza mlečne kisline. Tudi pri nizkem tlaku kisika absolutna količina ATP, ADP in AMP ostane stabilna. Ti podatki kažejo, da je presnova hondrocitov usmerjena v maksimalno ohranjanje energije. Vendar se sintetična aktivnost in s tem procesi reparacije v hipoksičnih pogojih spremenijo.
Visoka napetost kisika vpliva tudi na presnovo hondrocitov, kar povzroči zmanjšanje sinteze proteoglikanov in DNK ter razgradnjo hrustančnega matriksa. Te učinke običajno spremlja nastajanje prostih kisikovih radikalov.
Vpliv koncentracije ionov in osmotskega tlaka okolja na delovanje hondrocitov
V nativnem hrustancu se koncentracija ionov bistveno razlikuje od koncentracije v drugih tkivih: vsebnost natrija v zunajceličnem mediju je 250–350 mmol, njegova osmolarnost pa 350–450 mosmol. Ko so hondrociti izolirani iz zunajceličnega hrustanca in inkubirani v standardnem mediju (DMEM (Dulbeccov minimalni esencialni medij), osmolarnost je 250–280,7 mosmol), se okolje, ki obdaja celice, dramatično spremeni. Poleg tega je koncentracija kalcija in kalija v standardnem mediju bistveno nižja kot v nativnem tkivu, koncentracija anionov pa je bistveno višja.
Dodatek saharoze v medij poveča njegovo osmolarnost in povzroči prehodno znotrajcelično povečanje koncentracije H + in kalcijevih anionov v citosolu. Takšne znotrajcelične spremembe lahko vplivajo na procese diferenciacije hondrocitov in njihovo presnovno aktivnost. J. Urban in sod. (1993) so ugotovili, da je bila vključitev 35⁶ -sulfata in 3H -prolina v izolirane hondrocite, inkubirane v standardnem DMEM 2–4 ure, le 10 % tiste v nativnem tkivu. Intenzivnost sinteze je dosegla maksimum pri osmolarnosti zunajceličnega medija 350–400 mosmol tako v sveže izoliranih hondrocitih kot v eksplantih hrustančnega tkiva. Poleg tega se je volumen hondrocitov po namestitvi izoliranih celic v standardni DMEM z določeno osmolarnostjo povečal za 30–40 %. Vendar pa se pri gojenju hondrocitov v pogojih nefiziološke osmolarnosti 12-16 ur celice prilagodijo novim pogojem in zmanjšajo intenzivnost biosinteze sorazmerno s premikom osmolarnosti zunajceličnega okolja.
P. Borgetti in sodelavci (1995) so preučevali vpliv osmolarnosti zunajceličnega medija na rast, morfologijo in biosintezo prašičjih hondrocitov. Avtorji so pokazali podobne biokemične in morfološke značilnosti hondrocitov, gojenih v medijih z osmolarnostjo 0,28 in 0,38 mosmol. Pri osmolarnosti medija 0,48 mosmol je bilo v prvih 4–6 urah gojenja opaženo zmanjšanje proliferacije celic in sinteze beljakovin, vendar so se ti parametri nato obnovili in sčasoma dosegli kontrolne vrednosti. Ko so hondrocite gojili v mediju z osmolarnostjo 0,58 mosmol, so celice izgubile sposobnost vzdrževanja fiziološke intenzivnosti proliferativnih procesov in po 6 dneh se je število hondrocitov znatno zmanjšalo. Pri osmolarnosti medija 0,58 mosmol je bilo opaženo močno zaviranje sinteze beljakovin. Poleg tega hondrociti pri gojenju v gojiščih z osmolarnostjo 0,28–0,38 mOsm ohranijo svoj fiziološki fenotip; pri višji osmolarnosti (0,48–0,58 mOsm) pa pride do pomembnih sprememb v celični morfologiji, kar se kaže v izgubi značilnega fenotipa, transformaciji hondrocitov v celice, podobne fibroblastom, in izgubi sposobnosti celic za sestavljanje matričnih proteoglikanov. Rezultati te študije kažejo na sposobnost hondrocitov, da se odzovejo na omejena nihanja osmolarnosti zunajceličnega okolja.
Spremembe koncentracije drugih ionov lahko vplivajo tudi na procese biosinteze v hondrocitih. Tako se stopnja vključitve 35S (sulfata) poveča za polovico s povečanjem koncentracije kalijevih ionov s 5 mmol (koncentracija v standardnem mediju DM EM) na 10 mmol (koncentracija v ECM in vivo). Koncentracije kalcija pod 0,5 mmol so spodbujale proizvodnjo kolagena v zrelih govejih hondrocitih, medtem ko je koncentracija 1-2 mmol (ki ustreza koncentraciji v standardnem mediju DM EM) povzročila znatno zmanjšanje sinteze kolagena. Pri visokih ravneh kalcija (2-10 mmol) so opazili zmerno povečanje biosinteze. Pri vezavi hondrocitov na beljakovine ECM sodelujejo različni kationi. Tako magnezijevi in manganovi ioni zagotavljajo vezavo na fibronektin in kolagen tipa II, medtem ko kalcijevi ioni ne sodelujejo pri vezavi hondrocitov na beljakovine. Rezultati opisanih študij torej kažejo na vpliv sprememb zunajceličnih ionov kalija, natrija, kalcija in osmolarnosti medija na biosintetsko funkcijo hondrocitov, inkubiranih v standardnih medijih.
Vpliv mehanskega stresa na presnovo hondrocitov
Imobilizacija sklepov povzroča reverzibilno atrofijo hrustanca, kar kaže na potrebo po mehanskih dražljajih za normalne presnovne procese v zunajceličnem kostnem mozgu (ECM). V večini primerov uporabljeni modeli celičnih kultur obstajajo pod normalnim atmosferskim tlakom. M. Wright in sodelavci (1996) so pokazali, da mehansko okolje vpliva na presnovo hondrocitov, celični odziv pa je odvisen od intenzivnosti in pogostosti kompresijske obremenitve. Poskusi z obremenitvijo eksplantatov intaktnega sklepnega hrustanca in vitro so pokazali zmanjšanje sinteze beljakovin in proteoglikanov pod vplivom statične obremenitve, medtem ko dinamična obremenitev te procese spodbuja. Natančni mehanizmi vpliva mehanske obremenitve na hrustanec so kompleksni in so verjetno povezani z deformacijo celic, hidrostatičnim tlakom, osmotskim tlakom, električnim potencialom in površinskimi celičnimi receptorji za molekule matriksa. Za preučevanje vpliva vsakega od teh parametrov je treba ustvariti sistem, v katerem se lahko en parameter spreminja neodvisno. Na primer, kultura eksplantatov ni primerna za preučevanje deformacije celic, lahko pa se uporabi za preučevanje splošnega vpliva tlaka na presnovno aktivnost hondrocitov. Stiskanje hrustanca vodi do deformacije celic, spremlja pa ga tudi pojav hidrostatičnega gradienta tlaka, električnega potenciala, pretoka tekočine in sprememb fizikalno-kemijskih parametrov, kot so vsebnost vode v matriksu, gostota električnega naboja in raven osmotskega tlaka. Deformacijo celic lahko preučujemo z uporabo izoliranih hondrocitov, potopljenih v agarozni ali kolagenski gel.
Razvitih je bilo več sistemov za preučevanje vpliva mehanske stimulacije na kulturo hondrocitov. Nekateri raziskovalci uporabljajo sisteme, v katerih se na celično kulturo izvaja tlak skozi plinsko fazo. Tako so JP Veldhuijzen in sod. (1979) z uporabo tlaka 13 kPa nad atmosferskim z nizko frekvenco (0,3 Hz) 15 minut opazili povečanje sinteze cAMP in proteoglikanov ter zmanjšanje sinteze DNK. R. Smith in sod. (1996) so pokazali, da je občasna izpostavljenost kulture primarnih govejih hondrocitov hidrostatičnemu tlaku (10 MPa) s frekvenco 1 Hz 4 ure povzročila povečanje sinteze agrekana in kolagena tipa II, medtem ko konstanten tlak na te procese ni vplival. Wright in sod. (1996) so z uporabo podobnega sistema poročali, da je ciklični tlak na celično kulturo povezan s hiperpolarizacijo celične membrane hondrocitov in aktivacijo kalijevih kanalov, odvisnih od Ca2 +. Tako učinke cikličnega tlaka posredujejo z raztezanjem aktivirani ionski kanali v membrani hondrocitov. Odziv hondrocitov na hidrostatični tlak je odvisen od pogojev celične kulture in frekvence uporabljene obremenitve. Tako ciklični hidrostatični tlak (5 MPa) zmanjša vgradnjo sulfata v monosloj hondrocitov pri frekvenci 0,05, 0,25 in 0,5 Hz, medtem ko se pri frekvenci, večji od 0,5 Hz, vgradnja sulfata v hrustančni eksplant poveča.
M. Bushmann in sodelavci (1992) so poročali, da hondrociti v agaroznih gelih spreminjajo biosintezo kot odziv na statično in dinamično mehansko obremenitev na enak način kot gojen intakten organ. Avtorji so ugotovili, da mehanska obremenitev ustvari hiperosmotski dražljaj s posledičnim znižanjem pH v hondrocitih.
Učinek mehanskega raztezanja je mogoče preučevati na celični kulturi, potopljeni v gel. Silo raztezanja je mogoče ustvariti z računalniško vodenim vakuumom. Ko je sistem pod določeno stopnjo vakuuma, se dno petrijevke s celično kulturo podaljša za znano količino, deformacija je največja na robovih dna posode in minimalna v sredini. Raztezanje se prenese tudi na hondrocite, gojene v petrijevki. S to metodo so K. Holm-vall in sod. (1995) pokazali, da se v celicah hondrosarkoma, gojenih v kolagenskem (tip II) gelu, poveča izražanje mRNA 2β integrina . 2βintegrin se lahko veže na kolagen tipa II. Velja za mehanoreceptor, saj interagira z beljakovinami, ki vežejo aktin, in tako povezuje zunajcelični matrični ovoj (ECM) in citoskelet.
Vpliv pH na presnovo hondrocitov
PH intersticijske tekočine zunajceličnega telesa hrustančnega tkiva je bolj kisel kot v drugih tkivih. A. Maroudas (1980) je določil pH sklepnega hrustančnega matriksa pri 6,9. B. Diamant in sodelavci (1966) so v patoloških pogojih ugotovili pH 5,5. Znano je, da hondrociti živijo pri nizkem PO2, kar kaže na pomembno vlogo glikolize (95 % vse presnove glukoze) pri presnovi teh celic; glikolizo spremlja nastajanje velike količine mlečne kisline.
Poleg zakisanja okolja s produkti glikolize so velikega pomena tudi same komponente matriksa. Velika količina fiksnega negativnega naboja na proteoglikanih spreminja zunajcelično ionsko sestavo: opazimo visoko koncentracijo prostih kationov (npr. H +, Na +, K + ) in nizko koncentracijo anionov (npr. O2, HCO3). Poleg tega se pod vplivom mehanske obremenitve voda izloča iz zunajceličnega matriksa, kar vodi do povečanja koncentracije fiksnih negativnih nabojev in privabljanja več kationov v matriks. To spremlja znižanje pH zunajceličnega okolja, kar vpliva na znotrajcelični pH in s tem spreminja presnovo hondrocitov. R. Wilkin in A. Hall (1995) sta preučevala vpliv pH zunajceličnega in znotrajceličnega okolja na biosintezo matriksa izoliranih govejih hondrocitov. Opazila sta dvojno modifikacijo sinteze matriksa z znižanjem pH. Rahlo znižanje pH (7,4 < pH < 7,1) za 50 % je povečalo vgradnjo 35 SO 4 in 3 H-prolina v hondrocite, medtem ko je globlje zakisanje medija (pH < 7,1) zavrlo sintezo za 75 % v primerjavi s kontrolo. Ustvarjanje nizkega pH (6,65) z uporabo amonijevih ionov je povzročilo zmanjšanje sinteze matriksa le za 20 %. Pridobljeni rezultati kažejo, da spremembe pH zunajceličnega medija za sintezo matriksa ni mogoče pojasniti le s spremembami pH znotrajceličnega medija. Poleg tega imajo hondrociti sposobnost uravnavanja znotrajceličnega pH z uporabo izmenjevalca Na +, H +, Ka + -odvisnega transporterja Cl_ - НСОС3 in H + /ATPaze.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
Vpliv sestave gojišča na presnovo hondrocitov
Gojišče za gojenje hondrocitov mora ustrezati eksperimentalnim pogojem. V zadnjih letih se za optimizacijo pogojev gojenja uporablja telečji serum. Vendar pa je treba pri uporabi seruma upoštevati številne pomembne točke:
- rast celic navzven z obrobja tkiva v organskih kulturah,
- variabilnost v sestavi serumov različnih serij,
- prisotnost neznanih komponent v njih,
- povečano tveganje za motnje in artefakte pri preučevanju vpliva različnih bioloških dejavnikov na presnovno aktivnost celic.
Primer slednjega je študija učinka EGF na hrustančne hondrocite pri podganah. EGF je spodbudil vključitev 3H -timidina in povečanje vsebnosti DNK v kulturi. Ta učinek je bil bolj izrazit pri nizkih serumskih koncentracijah (<1 %), pri visokih koncentracijah (>7,5 %) pa je učinek izginil.
Dobro je znano, da so ravni sinteze in razgradnje v DMEM, dopolnjenem s telečjim serumom, bistveno povečane v primerjavi s pogoji in vivo. Razlike med presnovo in vivo in in vitro so lahko posledica razlik med sinovialno tekočino in gojiščem, v katerem se celice gojijo. Lee in sod. (1997) so gojili mlade goveje hondrocite v agarozi z uporabo hranilnega gojišča, ki je vsebovalo DMEM, dopolnjen z 20 % telečjega seruma in veliko količino normalne alogenske sinovialne tekočine. Prisotnost sinovialne tekočine v gojišču je povzročila povečanje količine proteoglikanov, do 80 % celotne količine sinovialne tekočine. Ti rezultati kažejo, da sinovialna tekočina v kulturi povzroči podobno raven presnove kot in vivo, z visoko stopnjo sinteze glikozaminoglikanov in nizko stopnjo delitve celic.
G. Verbruggen in sod. (1995) so pokazali, da je sinteza 35S -arrpeKaHa s strani človeških hondrocitov, gojenih v agarozi v DMEM brez seruma, znašala 20–30 % ravni sinteze, opažene v DMEM, dopolnjenem z 10 % telečjega seruma. Avtorji so določili, v kolikšni meri so IGF-1, IGF-2, TGF-R ali inzulin obnovili proizvodnjo agrekanov v mediju brez seruma. Avtorji so zaključili, da je 100 ng/ml inzulina, IGF-1 ali IGF-2 delno obnovilo sintezo agrekanov na 39–53 % kontrolne ravni. Pri kombinaciji naštetih dejavnikov ni bilo opaženega sinergizma ali kumulacije. Hkrati je 10 ng/ml TGF-R v prisotnosti 100 ng/ml inzulina spodbudilo sintezo agrekanov na 90 % ali več referenčne ravni. Končno, človeški serumski transferin, sam ali v kombinaciji z inzulinom, ni vplival na sintezo agrekanov. Ko je bil telečji serum zamenjan z govejim serumskim albuminom, se je vsebnost agrekanskih agregatov znatno zmanjšala. Obogatitev gojišča z insulinom, IGF ali TGF-R je delno obnovila sposobnost celic za tvorbo agrekanskih agregatov. Poleg tega sta IGF-1 in insulin sposobna vzdrževati homeostazo v celičnih kulturah. Po 40 dneh gojenja v gojišču, obogatenem z 10–20 ng/ml IGF-1, se je sinteza proteoglikanov ohranila na enaki ali celo višji ravni v primerjavi z gojiščem, ki je vsebovalo 20 % telečjega seruma. Katabolni procesi so v gojišču, obogatenem z IGF-1, potekali počasneje kot v gojišču, obogatenem z 0,1 % raztopino albumina, nekoliko hitreje pa v gojišču, obogatenem z 20 % seruma. V dolgoživih kulturah 20 ng/ml IGF-1 vzdržuje stabilno stanje celic.
D. Lee in sodelavci (1993) so primerjali vpliv sestave gojišča (DMEM, DMEM + 20 % telečjega seruma, DMEM + 20 ng/ml IGF-1) na sintezo DNK v kulturi eksplantata hrustančnega tkiva, monoslojni kulturi in v agarozni suspenziji. Pri gojenju v agarozi v prisotnosti seruma so avtorji opazili nagnjenost hondrocitov k združevanju v velike skupine. Celice, gojene brez seruma ali z IGF-1, so v agarozi ohranile okroglo obliko, zbrane v majhne skupine, vendar niso tvorile velikih agregatov. V monosloji je bila sinteza DNK bistveno višja v gojišču, ki je vsebovalo serum, kot v gojišču, obogatenem z IGF-1; sinteza DNK v slednjem je bila bistveno višja kot v neobogatenem gojišču. Pri gojenju hondrocitov v agarozni suspenziji v neobogatenem gojišču in v gojišču z IGF-1 niso ugotovili razlik v sintezi DNK. Hkrati je gojenje suspenzij hondrocitov v agarozi v mediju, obogatenem s serumom, spremljala povečana vključitev radionukleotida 3H -timidina v primerjavi z drugimi mediji.
Vitamin C je potreben za aktivacijo encimov, ki sodelujejo pri tvorbi stabilne vijačne strukture kolagenskih fibril. Hondrociti s pomanjkanjem askorbinske kisline sintetizirajo premalo hidroksilirane nevijačne predhodnike kolagena, ki se izločajo počasi. Dajanje askorbinske kisline (50 μg/ml) povzroči hidroksilacijo kolagena tipa II in IX ter njuno izločanje v normalnih količinah. Dodatek vitamina C ni vplival na raven sinteze proteoglikanov. Zato je izločanje kolagena regulirano neodvisno od izločanja proteoglikanov.

