Medicinski strokovnjak članka
Nove publikacije
Zdravljenje hude sepse in septičnega šoka
Zadnji pregled: 04.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Učinkovito zdravljenje sepse je možno le s popolno kirurško sanacijo mesta okužbe in ustreznim protimikrobnim zdravljenjem. Neustrezno začetno protimikrobno zdravljenje je dejavnik tveganja za smrt pri bolnikih s sepso. Ohranjanje bolnikovega življenja, preprečevanje in odpravljanje disfunkcij organov je mogoče le s ciljno usmerjeno intenzivno nego.
Njegov glavni cilj je optimizacija transporta O2 v pogojih njegove povečane porabe, kar je značilno za hudo sepso in septični šok. To zdravljenje se izvaja s hemodinamsko in respiratorno podporo.
Hemodinamska podpora
Infuzijska terapija
Infuzijska terapija je eden prvih ukrepov za vzdrževanje hemodinamike in predvsem srčnega iztisa. Njene glavne naloge pri bolnikih s sepso so:
- obnova ustrezne tkivne perfuzije,
- korekcija motenj homeostaze,
- normalizacija celičnega metabolizma,
- zmanjšanje koncentracije mediatorjev septične kaskade in strupenih metabolitov.
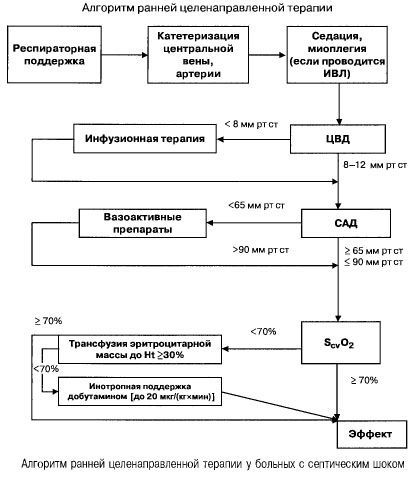
Pri sepsi z odpovedjo več organov in septičnim šokom poskušajo hitro (v prvih 6 urah) doseči naslednje vrednosti pomembnih kazalnikov:
- hematokrit >30 %,
- diureza 0,5 ml/(kgh),
- nasičenost krvi v zgornji votli veni ali desnem atriju >70 %,
- povprečni krvni tlak > 65 mm Hg,
- CVP 8–12 mm Hg
Vzdrževanje teh vrednosti na določeni ravni izboljša preživetje bolnikov (kategorija dokazov B). Hemodinamsko spremljanje z uporabo Swan-Ganzovega katetra in tehnologije PICCO (transpulmonalna termodilucijska analiza in analiza pulznega vala) širi možnosti za spremljanje in ocenjevanje učinkovitosti hemodinamske terapije, vendar ni dokazov, da bi izboljšali preživetje.
Optimalna vrednost prednapetosti se izbere individualno, saj je treba upoštevati stopnjo poškodbe endotelija in stanje limfne drenaže v pljučih, diastolično funkcijo prekatov in spremembe intratorakalnega tlaka. Volumen infuzijske terapije se izbere tako, da PCWP ne preseže plazemskega COP (preprečevanje OL) in pride do povečanja CO. Poleg tega se upoštevajo parametri, ki označujejo funkcijo izmenjave plinov v pljučih (paO2 in paO2 / FiO2 ), in spremembe v radiografski sliki.
Za infuzijsko terapijo kot del ciljnega zdravljenja sepse in septičnega šoka se uporabljajo kristaloidne in koloidne raztopine s praktično enakimi rezultati.
Vsi infuzijski mediji imajo tako prednosti kot slabosti. Danes glede na rezultate eksperimentalnih in kliničnih študij ni razloga za dajanje prednosti kateri koli določeni vrsti.
- Na primer, za ustrezno korekcijo venskega vračanja in ravni prednapetosti je potrebno dajati volumen kristaloidov, ki je 2-4-krat večji od volumna koloidov, kar je povezano s posebnostmi porazdelitve raztopine v telesu. Poleg tega je infuzija kristaloidov povezana z večjim tveganjem za edem tkiva, njihov hemodinamski učinek pa je krajši kot pri koloidih. Hkrati so kristaloidi cenejši, ne vplivajo na koagulacijski potencial in ne izzovejo anafilaktoidnih reakcij. Na podlagi zgoraj navedenega se kakovostna sestava infuzijskega programa določi glede na značilnosti bolnika, pri čemer se upošteva stopnja hipovolemije, faza DIC sindroma, prisotnost perifernega edema in koncentracija albumina v krvnem serumu ter resnost akutne poškodbe pljuč.
- V primerih hudega pomanjkanja bazalnoceličnega karcinoma (BCC) so indicirani nadomestki plazme (dekstrani, želatinski pripravki, hidroksietil škrob). Hidroksietil škrobi s stopnjo substitucije 200/0,5, 130/0,4 in 130/0,42 imajo potencialno prednost pred dekstrani zaradi manjšega tveganja za uhajanje skozi membrano in odsotnosti klinično pomembnega vpliva na hemostazo.
- Uvedba albumina v kritičnih stanjih lahko poveča tveganje za smrt. Povečanje COP med infuzijo je prehodno, nato pa v pogojih povečane prepustnosti kapilarnega dna (sindrom "kapilarnega puščanja") pride do nadaljnje ekstravazacije albumina. Možno je, da bo transfuzija albumina koristna le, če je njegova koncentracija v serumu manjša od 20 g/l in ni znakov "puščanja" v intersticij.
- Uporaba krioplazme je indicirana pri konzumacijski koagulopatiji in zmanjšanem koagulacijskem potencialu krvi.
- Široka uporaba mase donorskih eritrocitov bi morala biti omejena zaradi visokega tveganja za razvoj različnih zapletov (APL, anafilaktične reakcije itd.). Po mnenju večine strokovnjakov je minimalna koncentracija hemoglobina pri bolnikih s hudo sepso 90-100 g/l.
Korekcija hipotenzije
Nizek perfuzijski tlak zahteva takojšnjo aktivacijo zdravil, ki povečajo žilni tonus in/ali inotropno funkcijo srca. Dopamin ali norepinefrin sta zdravili prve izbire za odpravo hipotenzije pri bolnikih s septičnim šokom.
Dopamin (dopmin) v odmerku < 10 mcg/(kg x min) zviša krvni tlak, predvsem s povečanjem CO, in ima minimalen učinek na sistemski žilni upor. Pri visokih odmerkih prevladuje njegov α-adrenergični učinek, kar vodi do arterijske vazokonstrikcije, pri odmerku < 5 mcg/(kg x min) pa dopamin stimulira dopaminergične receptorje ledvičnih, mezenteričnih in koronarnih žil, kar vodi do vazodilatacije, povečane glomerularne filtracije in izločanja Na+.
Norepinefrin zviša povprečni arterijski tlak in poveča glomerularno filtracijo. Optimizacija sistemske hemodinamike pod njegovim delovanjem vodi do izboljšanja delovanja ledvic brez uporabe nizkih odmerkov dopamina. Študije v zadnjih letih so pokazale, da njegova izolirana uporaba v primerjavi s kombinacijo z visokimi odmerki dopamina vodi do statistično značilnega zmanjšanja umrljivosti.
Adrenalin je adrenergično zdravilo z najizrazitejšimi hemodinamskimi stranskimi učinki. Ima od odmerka odvisen učinek na srčni utrip, povprečni arterijski tlak, srčni izpust, funkcijo levega prekata ter dovajanje in porabo O2 . Vendar pa se sočasno pojavljajo tahiaritmije, poslabšanje pretoka krvi v organih in hiperlaktatemija. Zato je uporaba adrenalina omejena na primere popolne odpornosti na druge kateholamine.
Dobutamin je zdravilo izbire za povečanje dovajanja in porabe CO in O2 pri normalni ali povišani prednapetosti. Zaradi prevladujočega delovanja na beta1-adrenergične receptorje je pri povečanju teh parametrov učinkovitejši od dopamina.
Eksperimentalne študije so pokazale, da lahko kateholamini poleg podpore krvnemu obtoku uravnavajo potek sistemskega vnetja z vplivom na sintezo ključnih mediatorjev z oddaljenim učinkom. Pod vplivom adrenalina, dopamina, noradrenalina in dobutamina aktivirani makrofagi zmanjšajo sintezo in izločanje TNF-a.
Izbira adrenergičnih zdravil se izvaja po naslednjem algoritmu:
- srčni indeks 3,5–4 l/(min x m² ), SvO² > 70 % – dopamin ali norepinefrin,
- srčni indeks <3,5 l/(min x m2 ), SvO2 <70 % - dobutamin (če je sistolični krvni tlak <70 mm Hg - skupaj z norepinefrinom ali dopaminom).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Podpora dihanju
Pljuča so med prvimi tarčnimi organi, ki so vključeni v patološki proces pri sepsi. Akutna respiratorna odpoved je ena vodilnih komponent disfunkcije več organov. Njene klinične in laboratorijske manifestacije pri sepsi ustrezajo ALI, z napredovanjem patološkega procesa pa - ARDS. Indikacije za mehansko ventilacijo pri hudi sepsi so določene glede na resnost parenhimatozne respiratorne odpovedi (ARF ali ARDS). Njen kriterij je respiratorni indeks:
- <200 - indicirana je intubacija sapnika in respiratorna podpora,
- >200 - odčitki se določajo individualno.
Če je bolnik med spontanim dihanjem s podporo kisika pri zavesti, ni visoke porabe dihanja in izrazite tahikardije (HR <120 na minuto), normalna vrednost venskega vračanja SO2 > 90 %, potem ga je mogoče opustiti pri prenosu na umetno ventilacijo. Vendar je treba skrbno spremljati bolnikovo stanje. Optimalna vrednost SO2 je približno 90 %. Vzdržujemo jo lahko z različnimi metodami dovajanja plina (obrazne maske, nosni katetri) v netoksičnih koncentracijah (FiO2 < 0,6). Neinvazivna umetna ventilacija je kontraindicirana pri sepsi (kategorija dokazov B).
Izogibati se je treba načinom mehanske ventilacije z visokim volumnom (VO2 = 12 ml/kg), saj se v takih primerih poveča izločanje citokinov iz pljuč, kar vodi v poslabšanje MOF. Upoštevati je treba koncept varne mehanske ventilacije, ki je mogoča, če so izpolnjeni naslednji pogoji (kategorija dokazov A):
- DO <10 ml/kg,
- neinvertirano razmerje vdiha in izdiha,
- najvišji tlak v dihalnih poteh <35 cm H2O,
- FiO2 <0,6 .
Izbor parametrov dihalnega cikla se izvaja, dokler ni dosežena ustrezna mehanska ventilacija, njeni kriteriji so paO2 > 60 mm Hg, SpO2 > 88-93 %, pvO2 35-45 mm Hg, SvO2 > 55 %.
Ena od učinkovitih metod za optimizacijo izmenjave plinov je izvajanje umetne ventilacije v ležečem položaju (Prone Positioning) (kategorija dokazov B). Ta položaj je učinkovit pri bolnikih v najtežjem stanju, čeprav je njegov vpliv na zmanjšanje umrljivosti v dolgoročnem obdobju statistično nepomemben.
Prehranska podpora
Izvajanje umetne prehranske podpore je pomemben element zdravljenja, eden od obveznih ukrepov, saj razvoj sindroma odpovedi več organov pri sepsi običajno spremljajo manifestacije hipermetabolizma. V takšni situaciji se energijske potrebe zadovoljujejo z uničenjem lastnih celičnih struktur (avtokanibalizem), kar poslabša disfunkcijo organov in poveča endotoksikozo.
Prehranska podpora velja za metodo preprečevanja hude izčrpanosti (pomanjkanje beljakovin in energije) na ozadju izrazitega povečanja kata- in presnove. Vključitev enteralne prehrane v kompleks intenzivne terapije preprečuje gibanje črevesne mikroflore, disbakteriozo, povečuje funkcionalno aktivnost enterocitov in zaščitne lastnosti črevesne sluznice. Ti dejavniki zmanjšujejo stopnjo endotoksikoze in tveganje za sekundarne infekcijske zaplete.
Izračun prehranske podpore:
- energijska vrednost - 25-35 kcal/(kg telesne teže x dan),
- količina beljakovin - 1,3-2,0 g/(kg telesne teže x dan),
- količina ogljikovih hidratov (glukoze) - manj kot 6 g/kg/dan,
- količina maščobe - 0,5-1 g/kg/dan,
- glutamin dipeptidi 0,3–0,4 g/kg/dan,
- vitamini - standardni dnevni nabor + vitamin K (10 mg/dan) + vitamina B1 in B6( 100 mg/dan) + vitamini A, C, E,
- mikroelementi - standardni dnevni nabor + Zn (15-20 mg/dan + 10 mg/dan ob prisotnosti mehkega blata),
- elektroliti - Na+, K+, Ca2+ glede na izračune ravnotežja in koncentracijo v plazmi.
Zgodnji začetek prehranske podpore (24–36 ur) je učinkovitejši kot 3.–4. dan intenzivne terapije (kategorija dokazov B), zlasti pri enteralnem hranjenju po sondi.
Pri hudi sepsi ni prednosti enteralne ali parenteralne prehrane; trajanje disfunkcije organov in trajanje respiratorne in inotropne podpore sta enaka, stopnje umrljivosti pa so enake. Glede na zgoraj navedeno je zgodnja enteralna prehrana cenejša alternativa parenteralni prehrani. Uporaba mešanic, obogatenih s prehranskimi vlakninami (prebiotiki), za hranjenje po sondi bistveno zmanjša pojavnost driske pri bolnikih s hudo sepso.
Za učinkovito sintezo beljakovin v telesu je pomembno vzdrževati presnovno razmerje "skupni dušik, g - nebeljakovinske kalorije, kcal" = 1-(110-130). Največji odmerek ogljikovih hidratov je 6 g / (kg telesne teže na dan), saj vnos velikih odmerkov ogroža hiperglikemijo in aktivacijo katabolizma v skeletnih mišicah. Maščobne emulzije je priporočljivo dajati 24 ur na dan.
Kontraindikacije za prehransko podporo:
- dekompenzirana metabolična acidoza,
- individualna intoleranca na prehranska sredstva,
- huda nezdravljena hipovolemija,
- refraktorni šok - odmerek dopamina >15 mcg/(kg x min) in sistolični krvni tlak <90 mm Hg,
- huda neozdravljiva arterijska hipoksemija.
Glikemični nadzor
Pomemben vidik kompleksnega zdravljenja hude sepse je stalno spremljanje koncentracije glukoze v krvni plazmi in inzulinska terapija. Visoka glikemija in potreba po njeni korekciji sta dejavnika neugodnega izida sepse. Glede na zgoraj navedene okoliščine se pri bolnikih vzdržuje normoglikemija (4,5–6,1 mmol/l), pri čemer se ob povečanju koncentracije glukoze nad sprejemljive vrednosti izvaja infuzija inzulina (0,5–1 U/h). Glede na klinično situacijo se koncentracija glukoze spremlja vsake 1–4 ure. Pri izvajanju tega algoritma je bilo opaženo statistično značilno povečanje preživetja bolnikov.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glukokortikoidi
Rezultati sodobnih študij o učinkovitosti uporabe glukokortikoidov pri bolnikih s septičnim šokom so povzeti v naslednjih trditvah:
- Uporaba hormonov v visokih odmerkih ni primerna [metilprednizolon 30–120 mg/(kg x dan) enkrat ali 9 dni, deksametazon 2 mg/(kg x dan) 2 dni, betametazon 1 mg/(kg x dan) 3 dni] – povečano tveganje za bolnišnične okužbe, brez vpliva na preživetje,
- Uporaba hidrokortizona v odmerku 240–300 mg na dan 5–7 dni pospeši stabilizacijo hemodinamskih parametrov, omogoči ukinitev žilne podpore in izboljša preživetje pri bolnikih s sočasno relativno insuficienco nadledvične žleze (kategorija dokazov B).
Treba je opustiti kaotično empirično predpisovanje prednizolona in deksametazona - ni razlogov za ekstrapolacijo novih informacij nanje. Če ni laboratorijskih dokazov o relativni insuficienci nadledvične žleze, se hidrokortizon daje v odmerku 300 mg na dan (v 3-6 injekcijah).
- pri refraktornem šoku,
- če so za vzdrževanje učinkovite hemodinamike potrebni visoki odmerki vazopresorjev.
Možno je, da je v pogojih sistemskega vnetja pri septičnem šoku učinkovitost hidrokortizona povezana z aktivacijo zaviralca jedrskega faktorja kB (NF-kB-a) in korekcijo relativne adrenalne insuficience. Zaviranje aktivnosti transkripcijskega jedrskega faktorja (NF-kB) posledično vodi do zmanjšanja nastajanja inducibilne NO sintetaze (NO je najmočnejši endogeni vazodilatator), provnetnih citokinov, COX in adhezijskih molekul.
Aktivirani protein C
Ena od značilnih manifestacij sepse je motnja sistemske koagulacije (aktivacija koagulacijske kaskade in zaviranje fibrinolize), kar na koncu vodi do hipoperfuzije in disfunkcije organov. Učinek aktiviranega proteina C na vnetni sistem se uresničuje na več načinov:
- zmanjšanje vezave selektina na levkocite, kar ščiti endotelij pred poškodbami, kar igra ključno vlogo pri razvoju sistemskega vnetja,
- zmanjšano sproščanje citokinov iz monocitov,
- zaviranje sproščanja TNF-a iz levkocitov,
- zaviranje nastajanja trombina (poveča vnetni odziv).
Antikoagulantno, profibrinolitično in protivnetno delovanje
- aktivirani protein C je posledica
- razgradnja faktorjev Va in VIIIa - zaviranje nastajanja trombov,
- supresija zaviralca aktivatorja plazminogena - aktivacija fibrinolize,
- neposreden protivnetni učinek na endotelijske celice in nevtrofilce,
- zaščita endotelija pred apoptozo
Dajanje aktiviranega proteina C [drotrekogin alfa (aktiviran)] v odmerku 24 mcg/(kg h) 96 ur zmanjša tveganje za smrt za 19,4 %. Indikacije za dajanje: sepsa z akutno MOF in visokim tveganjem za smrt (APACHE II > 25 točk, disfunkcija 2 ali več organov, kategorija dokazov B).
Aktivirani protein C ne zmanjša umrljivosti pri otrocih, bolnikih z disfunkcijo enega organa, APACHE II < 25 točk, pri bolnikih z nekirurško sepso.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Imunoglobulini
Priporočljivost intravenske uporabe imunoglobulinov (IgG in IgG+IgM) je povezana z njihovo sposobnostjo omejevanja prekomernega delovanja provnetnih citokinov, povečanja očistka endotoksinov in stafilokoknega superantigena, odpravljanja anergičnosti in krepitve učinka ß-laktamskih antibiotikov. Njihova uporaba pri zdravljenju hude sepse in septičnega šoka je edina metoda imunokorekcije, ki poveča preživetje. Najboljši učinek je bil zabeležen pri uporabi kombinacije IgG in IgM [RR=0,48 (0,35–0,75), kategorija dokazov A]. Standardni režim odmerjanja je 3–5 ml/(kg x dan) 3 dni zapored. Pri uporabi imunoglobulinov so bili najbolj optimalni rezultati doseženi v zgodnji fazi šoka ("topli šok") in pri bolnikih s hudo sepso (ocena APACHE II 20–25 točk).
Preprečevanje globoke venske tromboze
Preprečevanje globoke venske tromboze spodnjih okončin pomembno vpliva na izide zdravljenja bolnikov s sepso (kategorija dokazov A). Za ta namen se uporabljajo tako nefrakcionirani kot nizkomolekularni heparini. Glavne prednosti nizkomolekularnih heparinov so manjša incidenca hemoragičnih zapletov, šibkejši učinek na delovanje trombocitov in dolgotrajen učinek (lahko se dajejo enkrat na dan).
Preprečevanje nastanka stresnih razjed v prebavilih
Ta smer igra pomembno vlogo pri ugodnem izidu zdravljenja bolnikov s hudo sepso in septičnim šokom, saj je stopnja umrljivosti zaradi krvavitve iz stresnih razjed v prebavilih 64–87 %. Brez preventivnih ukrepov se stresne razjede pojavijo pri 52,8 % kritično bolnih bolnikov. Vendar pa uporaba zaviralcev protonske črpalke in zaviralcev histaminskih receptorjev H2 zmanjša tveganje za več kot 2-krat (prva skupina zdravil je učinkovitejša od druge). Glavna smer preprečevanja in zdravljenja je vzdrževanje pH med 3,5 in 6,0. Poudariti je treba, da poleg zgoraj omenjenih zdravil pomembno vlogo pri preprečevanju nastanka stresnih razjed igra tudi enteralna prehrana.
Ekstrakorporalno čiščenje krvi
Različne biološko aktivne snovi in presnovni produkti, ki sodelujejo pri razvoju generaliziranega vnetja, so tarče metod razstrupljanja, kar je še posebej pomembno ob odsotnosti naravnega hepatorenalnega očistka v pogojih odpovedi več organov. Metode nadomestnega ledvičnega zdravljenja veljajo za obetavne, saj lahko vplivajo ne le na uremične motnje pri bolnikih z odpovedjo ledvic, temveč pozitivno vplivajo tudi na druge spremembe homeostaze in disfunkcije organov, ki se pojavljajo pri sepsi, šoku in odpovedi več organov.
Do danes ni podatkov, ki bi potrjevali potrebo po uporabi zunajtelesnih metod čiščenja krvi kot ene glavnih smeri patogenetskega zdravljenja sepse in septičnega šoka. Njihova uporaba je upravičena v primeru odpovedi več organov z dominantno ledvično funkcijo.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hemodializa
Bistvo metode je difuzija snovi z nizko molekulsko maso (do 5x103 Da ) skozi polprepustno membrano in odstranjevanje odvečne tekočine iz telesa vzdolž tlačnega gradienta. Hemodializa se pogosto uporablja za zdravljenje bolnikov s kronično in akutno ledvično odpovedjo. Hitrost difuzije snovi je eksponentno odvisna od njihove molekulske mase. Na primer, odstranjevanje oligopeptidov je počasnejše od njihove sinteze.
Hemofiltracija
Hemofiltracija je učinkovita metoda za odstranjevanje snovi z molekulsko maso 5x10³ - 5x10⁴ Da in edini način za odstranitev velike skupine biološko aktivnih snovi in presnovkov iz telesa. Metoda temelji na konvekcijski metodi prenosa mase. Poleg ustrezne korekcije azotemije hemofiltracija učinkovito odstrani anafilatoksine C3a, C5a, provnetne citokine (TNF-a, IL-1b, 6 in 8), ß2-mikroglobulin, mioglobin, paratiroidni hormon, lizocim (molekulska masa - 6000 Da), α-amilazo (molekulska masa - 36.000-51.000 Da), kreatin fosfokinazo, alkalno fosfatazo, transaminaze in druge snovi. Hemofiltracija odstranjuje aminokisline in plazemske beljakovine (vključno z imunoglobulini in imunskimi kompleksi v krvnem obtoku).
Hemodiafiltracija
Hemodiafiltracija je najmočnejša metoda čiščenja krvi, ki združuje difuzijo in konvekcijo (tj. GD in GF). Dodaten prispevek k procesu razstrupljanja ima sorpcija patoloških snovi na filtrirni membrani.
Plazmafereza
Plazmafereza (izmenjava plazme, plazemska filtracija) se prav tako šteje za možno metodo za odpravljanje generaliziranega vnetja pri bolnikih s sepso in septičnim šokom. Optimalna metoda velja za uporabo plazmafereze v neprekinjenem načinu z odstranitvijo 3-5 volumnov plazme in njeno hkratno nadomestitvijo s sveže zamrznjenimi, albuminskimi, koloidnimi in kristaloidnimi raztopinami. S koeficientom presejanja 1 plazemska filtracija zagotavlja dobro odstranitev C-reaktivnega proteina, haptoglobina, fragmenta komplementa C3, 1-antitripsina, IL-6, tromboksana-B2, granulocitno stimulirajočega faktorja, TNF. Uporaba sorbentov za čiščenje bolnikove plazme zmanjšuje tveganje za okužbo in znižuje stroške postopka, saj ni potrebe po uporabi tujih beljakovin.
Uporaba dolgotrajne infuzije natrijevega selenita (selenaze) v odmerku 1000 mcg/dan pri hudi sepsi zmanjša umrljivost.
Selen je esencialni mikroelement, katerega pomen je povezan z njegovo ključno vlogo v antioksidativnih sistemih celic. Raven selena v krvi se vzdržuje v območju 1,9–3,17 μM/l. Potreba po selenu je 50–200 μg na dan in je odvisna od razpoložljivosti drugih antioksidantov in mikroelementov.
Selen je močan antioksidant, sestavni del glutation peroksidaze, fosfolin glutation peroksidaze, drugih oksidoreduktaz in nekaterih transferaz. Glutation peroksidaza je najpomembnejša povezava v endogenem antioksidativnem sistemu.
Učinkovitost selena v kritičnih pogojih je bila v zadnjih letih preučevana. Te študije so pokazale, da so glavni mehanizmi delovanja selena naslednji:
- zatiranje hiperaktivacije NF-kB;
- zmanjšana aktivacija komplementa;
- njegovo delovanje kot imunomodulator, antioksidant in protivnetno sredstvo
- vzdrževanje izkoriščanja peroksida;
- zaviranje endotelijske adhezije (zmanjšana ekspresija ICAM-1, VCAM-2,
- E - selektin, P - selektin);
- zaščita endotelija pred oksiradikali (z uporabo selenoproteina P, ki preprečuje nastanek peroksinitrita iz O2 in NO).
Če povzamemo zgoraj navedeno, lahko opredelimo specifične naloge intenzivne nege za hudo sepso:
- Hemodinamska podpora: CVP 8–12 mm Hg, povprečni krvni tlak > 65 mm Hg, diureza 0,5 ml/(kg h), hematokrit > 30 %, nasičenost mešane venske krvi > 70 %.
- Najvišji tlak v dihalnih poteh pri dihalni podpori <35 cm H2O, inspiracijski delež kisika <60 %, dihalni volumen <10 ml/kg, neinvertirano inspiracijsko/izdihano razmerje.
- Glukokortikoidi - "nizki odmerki" (hidrokortizon 240-300 mg na dan).
- Aktivirani protein C 24 mcg/(kg h) 4 dni pri hudi sepsi (APACHE II > 25).
- Imunokorekcijska nadomestna terapija s pentaglobinom.
- Preprečevanje globoke venske tromboze spodnjih okončin.
- Preprečevanje nastanka stresnih razjed v prebavilih: uporaba zaviralcev protonske črpalke in zaviralcev H2-histaminskih receptorjev.
- Nadomestno zdravljenje za akutno odpoved ledvic.
- Prehranska podpora: energijska vrednost hrane 25-30 kcal/kg telesne teže x dan), beljakovine 1,3-2,0 g/(kg telesne teže x dan), glutamin dipeptidi 0,3-0,4 g/(kg x dan), glukoza - 30-70 % nebeljakovinskih kalorij, pod pogojem, da se glikemija vzdržuje <6,1 mmol/l, maščobe - 15-50 % nebeljakovinskih kalorij.

