Medicinski strokovnjak članka
Nove publikacije
Vzroki in patogeneza difterije
Zadnji pregled: 04.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
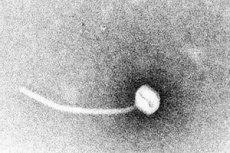
Davica je paradigma toksigenih nalezljivih bolezni. Leta 1883 je Klebs dokazal, da je povzročitelj davice Corynebacterium diphtheriae. Leto kasneje je Loeffler ugotovil, da je organizem mogoče gojiti le iz nazofaringealne votline, in predlagal, da je poškodba notranjih organov posledica topnega toksina. Do leta 1888 sta Roux in Yersin pokazala, da so živali, ki so jim injicirali sterilne filtrate C. diphtheriae, razvile patologijo organov, ki je ni mogoče razlikovati od človeške davice; to je dokazalo, da je glavni dejavnik virulence močan eksotoksin.
Davica je najpogostejša okužba zgornjih dihal, ki povzroča vročino, vneto grlo in slabo počutje. Na mestu(-ih) okužbe se pogosto tvori debela, sivozelena fibrinska membrana, psevdomembrana, kot posledica kombiniranih učinkov rasti bakterij, proizvodnje toksinov, nekroze osnovnega tkiva in imunskega odziva gostitelja. Spoznanje, da je sistemska poškodba organov posledica delovanja davičnega toksina, je privedlo do razvoja tako učinkovite terapije na osnovi antitoksinov za zdravljenje akutne okužbe kot tudi zelo učinkovitega cepiva proti toksinom.
Čeprav je zaradi cepljenja s toksoidi davica postala redka bolezen na območjih, kjer javnozdravstveni standardi zahtevajo cepljenje, se izbruhi davice še vedno pojavljajo pri necepljenih in imunsko oslabelih skupinah. Nasprotno pa so se na območjih, kjer so bili programi aktivnega cepljenja začasno ukinjeni, pojavili razširjeni izbruhi davice, ki so dosegli epidemične razsežnosti.
Druge vrste korinebakterij
Poleg C. diphtheriae, C. ulcerans in C. pseudotuberculosis lahko občasno povzročita okužbe nosno-žrelnega prostora in kože tudi C. pseudodiphtheriticum in C. xerosis. Slednja dva seva sta prepoznavna po sposobnosti proizvajanja pirazinamidaze. V veterinarski medicini sta C. renale in C. kutscheri pomembna patogena, ki povzročata pielonefritis pri govedu oziroma latentne okužbe pri miših.
Vzroki
Povzročitelj davice, Corynebacterium diphtheriae, je tanka, rahlo ukrivljena paličasta palčka s kijastimi odebelitvami na koncih, negibna; ne tvori spor, kapsul ali flagel in je grampozitivna.
Poleg toksina difterične korinebakterije med svojim življenjskim procesom proizvajajo nevraminidazo, hialuronidazo, hemolizin, nekrotizirajoče in difuzne faktorje, ki lahko povzročijo nekrozo in utekočinjenje glavne snovi vezivnega tkiva.
Glede na sposobnost tvorbe toksinov se korinebakterije davice delijo na toksigene in netoksigene.
Davični toksin je močan bakterijski eksotoksin, ki določa tako splošne kot lokalne klinične manifestacije bolezni. Toksigenost je genetsko pogojena. Netoksigene korinebakterije davice ne povzročajo bolezni.
Glede na kulturne in morfološke značilnosti so vse korinebakterije davice razdeljene na 3 variante: gravis, mitis, intermedius. Ni neposredne odvisnosti resnosti bolezni od variante korinebakterij davice. Vsaka varianta vsebuje tako toksigene kot netoksigene seve. Toksigene korinebakterije vseh variant proizvajajo enak toksin. [ 1 ]
Struktura, klasifikacija in vrste antigenov
Corynebacterium diphtheriae je grampozitivna, negibna paličasta bakterija. Sevi, ki rastejo v tkivu ali starejše kulture in vitro, vsebujejo drobne pike v celičnih stenah, ki omogočajo razbarvanje med barvanjem po Gramu in povzročijo spremenljivo Gramovo reakcijo. Starejše kulture pogosto vsebujejo metakromatske granule (polimetafosfat), ki se z metilenskim modrim obarvajo modrikasto-vijolično. Sladkorji v celičnih stenah vključujejo arabinozo, galaktozo in manozo. Poleg tega lahko izoliramo strupeni 6,6'-ester trehaloze, ki vsebuje korinemikolne in korinemikolenske kisline v ekvimolarnih koncentracijah. Prepoznane so tri različne vrste kultur: mitis, intermedius in gravis.
Večina sevov za rast potrebuje nikotinsko in pantotensko kislino; nekateri potrebujejo tudi tiamin, biotin ali pimelno kislino. Za optimalno proizvodnjo davičnega toksina je treba gojišče obogatiti z aminokislinami in ga dati na stran.
Že leta 1887 je Loeffler opisal izolacijo avirulentnih (netoksigenih) sevov C. diphtheriae, ki jih ni bilo mogoče razlikovati od virulentnih (toksigenih) sevov, izoliranih od bolnikov pri zdravih posameznikih. Zdaj je znano, da se avirulentni sevi C. diphtheriae lahko pretvorijo v virulentni fenotip po okužbi in lizogenizaciji z enim od številnih različnih korinebakteriofagov, ki nosijo strukturni gen za davični toksin, tox. Lizogena pretvorba avirulentnega v virulentni fenotip se lahko pojavi tako in situ kot in vitro. Strukturni gen za davični toksin ni bistven niti za korinebakteriofag niti za C. diphtheriae. Kljub temu opažanju genetskega drifta davičnega toksina niso opazili.
Patogeneza
Vstopne točke okužbe so sluznice orofarinksa, nosu, grla, redkeje sluznica oči in genitalij, pa tudi poškodovana koža, rane ali opekline, plenični izpuščaj, nezaceljena popkovina. Na vstopni točki se difterična korinebakterija razmnožuje in izloča eksotoksin.
Izloči se eksudat, bogat s fibrinogenom, ki se pod vplivom trombokinaze, ki se sprošča med nekrozo epitelijskih celic, pretvori v fibrin. Nastane fibrinski film – značilen znak davice.
Asimptomatsko nazofaringealno nosilstvo je pogosto v območjih, kjer je davica endemična. Pri dovzetnih posameznikih toksigeni sevi povzročajo bolezen z razmnoževanjem in izločanjem davičnega toksina v nazofarinksu ali kožnih lezijah. Davična lezija je pogosto prekrita s psevdomembrano, sestavljeno iz fibrina, bakterij in vnetnih celic. Davični toksin se lahko proteolitično razcepi na dva fragmenta: N-terminalni fragment A (katalitska domena) in fragment B (transmembranska in receptorsko vezavna domena). Fragment A katalizira NAD+-odvisno ADP-ribozilacijo elongacijskega faktorja 2, s čimer zavira sintezo beljakovin v evkariontskih celicah. Fragment B se veže na receptor na celični površini in olajša dostavo fragmenta A v citosol.
Zaščitna imunost vključuje odziv protiteles na davični toksin po klinični bolezni ali na davični toksin (toksin, inaktiviran s formaldehidom) po imunizaciji.
Kolonizacija
O dejavnikih, ki posredujejo pri kolonizaciji C. diphtheriae, je znanega malo. Vendar je jasno, da k virulenci prispevajo tudi drugi dejavniki, razen proizvodnje davičnega toksina. Epidemiološke študije so pokazale, da lahko določen lizotip v populaciji vztraja dlje časa. Kasneje ga lahko nadomesti drug lizotip. Pojav in posledična prevlada novega lizotipa v populaciji je verjetno povezana z njegovo sposobnostjo kolonizacije in učinkovitega tekmovanja v svojem segmentu nazofaringealne ekološke niše. Corynebacterium diphtheriae lahko proizvaja nevraminidazo, ki cepi sialno kislino na površini celic v njeni komponenti piruvat in N-acetilnevraminsko kislino. Kordni faktor (6,6'-di-O-mikoloil-α, α'-D-trehaloza) je površinska komponenta C. diphtheriae, vendar njegova vloga pri kolonizaciji človeškega gostitelja ni jasna.
Proizvodnja davičnih toksinov
Strukturni gen davičnega toksina, tox, spada v družino tesno sorodnih korinebakteriofagov, od katerih je β-fag najbolje preučen. Regulacijo izražanja davičnega toksina posreduje z železom aktivirani represor, DtxR, ki ga kodira genom C. diphtheriae. Izražanje toksina je odvisno od fiziološkega stanja C. diphtheriae. V pogojih, ko železo postane substrat, ki omejuje hitrost rasti, se železo disociira od DtxR, gen toksikodendron se aktivira in davični toksin se sintetizira in izloča v gojišče z maksimalno hitrostjo.
Davični toksin je nenavadno močan; za dovzetne vrste (npr. ljudi, opice, kunce, morske prašičke) je smrtonosen že odmerek od 100 do 150 ng/kg telesne teže. Davični toksin je sestavljen iz ene same polipeptidne verige s 535 aminokislinami. Biokemijska, genetska in rentgenska strukturna analiza kaže, da toksin sestavljajo tri strukturne/funkcionalne domene:
- N-terminalna ADP-riboziltransferaza (katalitska domena);
- regija, ki olajša dostavo katalitične domene skozi celično membrano (transmembranska domena);
- vezavna domena receptorja evkariontske celice.
Po blagi prebavi s tripsinom in redukciji v denaturacijskih pogojih se lahko davični toksin specifično cepi na svoji proteazno občutljivi zanki na dva polipeptidna fragmenta (A in B). Fragment A je N-terminalna 21 kDa komponenta toksina in vsebuje katalitično mesto za ADP-ribozilacijo elongacijskega faktorja 2 (EF-2).
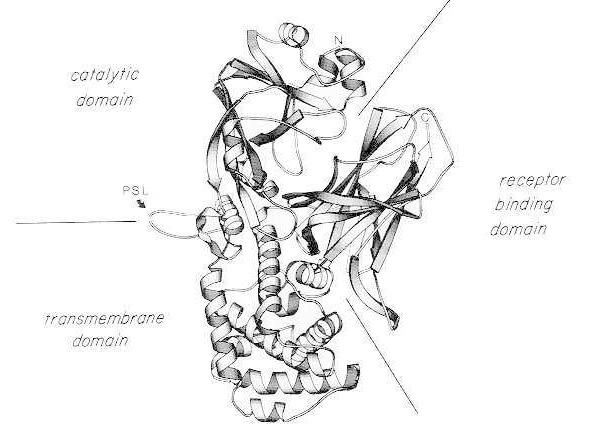
Trakasti diagram rentgenske kristalne strukture monomernega nativnega davičnega toksina. (spremenjeno po Bennett MJ, Choe S, Eisenberg D: Zamenjava domen: Prepletanje povezav med proteini. Proc Natl Acad Sci, ZDA, 91: 3127, 1994). Prikazani so relativni položaji katalitičnih, transmembranskih in receptorsko vezavnih domen. Nepoškodovani toksin lahko cepijo tripsinu podobne proteaze na Arg190, Arg192 in/ali Arg193, ki se nahajajo v proteazno občutljivi zanki (PSL). Po redukciji disulfidnega mostu med Cys186 in Cys201 se toksin lahko razdeli na fragmente A in B. Prikazana sta amino-terminalna (N) in karboksi-terminalna (C) končna. Trakasti diagram je bil ustvarjen s programom MOLESCRIPT.
C-terminalni fragment, fragment B, nosi transmembransko in receptorsko vezavno domeno toksina.
Zastrupitev posamezne evkariontske celice z davičnim toksinom vključuje vsaj štiri različne korake:
- vezava toksina na njegov receptor na celični površini;
- združevanje nabitih receptorjev v obložene jamice in internalizacija toksina preko receptorsko posredovane endocitoze; po zakisljevanju endocitnega vezikla z membransko povezano protonsko črpalko, ki jo poganja ATP,
- vstavitev transmembranske domene v membrano in olajšana dostava katalitične domene v citosol ter
- ADP-ribozilacija EF-2, kar povzroči nepovratno zaviranje sinteze beljakovin.
Dokazano je, da je ena sama molekula katalitične domene, dostavljena v citosol, dovolj, da je smrtonosna za celico.
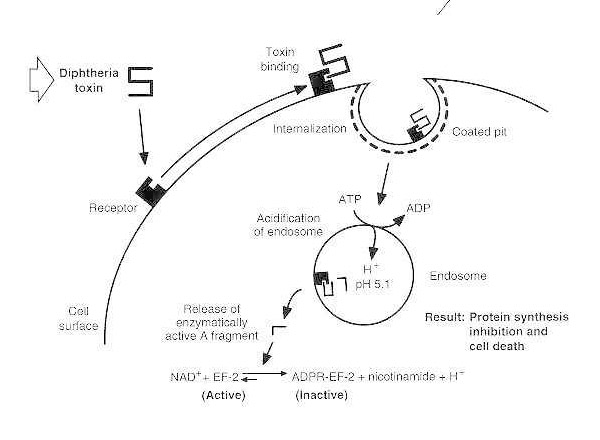
Shematski diagram zastrupitve dovzetne evkariontske celice z davico.
Toksin se veže na receptor na površini celic in se internalizira preko endocitoze, ki jo posreduje receptor; po zakisanju endosoma se transmembranska domena vstavi v membrano vezikla; katalitična domena pa se prenese v citosol, kar povzroči zaviranje sinteze beljakovin in celično smrt.
Epidemiologija
Pred množičnim cepljenjem prebivalstva ZDA z davičnim toksoidom je bila davica običajno otroška bolezen. Izjemen vidik množičnega cepljenja z davičnim toksoidom je, da se z naraščanjem odstotka prebivalstva z zaščitno stopnjo imunosti na antitoksine (≥ 0,01 ie/ml) zmanjšuje pogostost izolacije toksigenih sevov iz populacije. Danes je v Združenih državah Amerike, kjer je klinična davica skoraj popolnoma izginila, izolacija toksigenih sevov C. diphtheriae redka. Ker subklinična okužba ne predstavlja več vira izpostavljenosti davičnemu antigenu in ker imunost na antitoksine upade, razen če se ne okrepi, ima velik odstotek odraslih (30 do 60 %) raven antitoksinov pod zaščitno stopnjo in je ogrožen. V Združenih državah Amerike, Evropi in vzhodni Evropi so se nedavni izbruhi davice pojavili predvsem med posamezniki, ki zlorabljajo alkohol in/ali droge. Znotraj te skupine imajo nosilci toksigenih C. diphtheriae zmerno visoko stopnjo imunosti na antitoksine. Nedavni zlom javnozdravstvenih ukrepov v Rusiji je povzročil, da je davica postala epidemija. Do konca leta 1994 je bilo v Rusiji zabeleženih več kot 80.000 primerov in več kot 2.000 smrti.
Žarišni izbruhi davice so skoraj vedno povezani z imunskim nosilcem, ki se je vrnil iz regije, kjer je davica endemična. Dejansko so bili nedavni izbruhi klinične davice v Združenih državah Amerike in Evropi povezani s potniki, ki so se vrnili iz Rusije in vzhodne Evrope. Toksigeni sevi C. diphtheriae se prenašajo neposredno z osebe na osebo s kapljicami v zraku. Znano je, da lahko toksigeni sevi neposredno kolonizirajo nazofaringealno votlino. Poleg tega se lahko toksigeni gen širi posredno s sproščanjem toksigenega korinebakteriofaga in lizogeno transformacijo netoksigenega avtohtonega C. diphtheriae in situ. [ 5 ]
Poleg določanja biotipa in lizotipa izolatov C. diphtheriae se lahko za preučevanje izbruhov davice zdaj uporabljajo tudi tehnike molekularne biologije. Za preučevanje kliničnih izbruhov so bili uporabljeni vzorci prebave kromosomske DNK C. diphtheriae z restrikcijskimi endonukleazami, prav tako pa tudi uporaba kloniranih korinebakterijskih insercijskih zaporedij kot genetske sonde.
Schickov test se že vrsto let uporablja za oceno imunosti na davični toksin, čeprav ga je na mnogih območjih zdaj nadomestil serološki test za specifična protitelesa proti davičnemu toksinu. Pri Schickovem testu se majhna količina davičnega toksina (približno 0,8 ng v 0,2 ml) injicira intradermalno v podlaket (mesto testiranja), 0,0124 μg davičnega toksina v 0,2 ml pa se injicira intradermalno v kontrolno mesto. Odčitki se opravijo po 48 in 96 urah. Nespecifične kožne reakcije običajno dosežejo vrhunec po 48 urah. Po 96 urah eritematozna reakcija z možno nekrozo na mestu testiranja kaže na nezadostno antitoksično imunost za nevtralizacijo toksina (≤ 0,03 ie/ml). Vnetje na testnem in kontrolnem območju po 48 urah kaže na preobčutljivostno reakcijo na antigenski pripravek.
Obrazci
Corynebacterium diphtheriae okuži nosno-žrelo ali kožo. Toksigeni sevi proizvajajo močan eksotoksin, ki lahko povzroči davico. Simptomi davice vključujejo faringitis, vročino in otekanje vratu ali območja okoli kožne lezije. Davične lezije so prekrite s psevdomembrano. Toksin se širi po krvnem obtoku v oddaljene organe in lahko povzroči paralizo in kongestivno srčno popuščanje. [ 6 ]
Klinično obstajata dve vrsti davice: nazofaringealna in kožna. Simptomi faringealne davice segajo od blagega faringitisa do hipoksije zaradi obstrukcije dihalnih poti s psevdomembranom. Prizadetost vratnih bezgavk lahko povzroči hudo otekanje vratu (davica bikovega vratu), bolnik pa lahko razvije vročino (≥ 38 °C). Kožne lezije pri kožni davici so običajno prekrite s sivo-rjavo psevdomembrano. Zaradi delovanja davičnega toksina na periferne motorične nevrone in miokard se lahko razvijejo smrtno nevarni sistemski zapleti, predvsem izguba motorične funkcije (npr. težave pri požiranju) in kongestivno srčno popuščanje.
Nadzor
Nadzor davice je odvisen od ustrezne imunizacije z davičnim toksoidom: davičnim toksinom, ki ga inaktivira formaldehid, ki ostane antigensko nedotaknjen. Toksoid se pripravi z inkubacijo davičnega toksina s formaldehidom pri 37 °C v alkalnih pogojih. Imunizacija proti davici se mora začeti v drugem mesecu življenja s serijo treh primarnih odmerkov v intervalih od 4 do 8 tednov, ki jim sledi četrti odmerek približno 1 leto po zadnjem primarnem cepljenju. Davični toksoid se pogosto uporablja kot sestavina cepiva proti davici, oslovskemu kašlju in tetanusu (DPT). Epidemiološke študije so pokazale, da je imunizacija proti davici približno 97-odstotno učinkovita. Čeprav se v Združenih državah Amerike in Evropi izvaja množična imunizacija proti davici in so stopnje imunizacije otrok ustrezne, ima lahko velik delež odrasle populacije titre protiteles pod zaščitno ravnjo. Odrasle je treba ponovno cepiti z davičnim toksoidom vsakih 10 let. Dejansko je treba popotnike na območja z visoko stopnjo endemične davice (Srednja in Južna Amerika, Afrika, Azija, Rusija in Vzhodna Evropa) cepiti z obnovitvenim cepljenjem s toksoidom davice in tetanusa. V zadnjih letih je uporaba visoko prečiščenih toksoidnih pripravkov za imunizacijo zmanjšala občasne hude preobčutljivostne reakcije. Obnovitveno cepljenje s toksoidom davice in tetanusa je treba cepiti popotnike na območja z visoko stopnjo endemične davice (Srednja in Južna Amerika, Afrika, Azija, Rusija in Vzhodna Evropa). V zadnjih letih je uporaba visoko prečiščenih toksoidnih pripravkov za imunizacijo zmanjšala občasne hude preobčutljivostne reakcije. Obnovitveno cepljenje s toksoidom davice in tetanusa je treba cepiti popotnike na območja z visoko stopnjo endemične davice (Srednja in Južna Amerika, Afrika, Azija, Rusija in Vzhodna Evropa). V zadnjih letih je uporaba visoko prečiščenih toksoidnih pripravkov za imunizacijo zmanjšala občasne hude preobčutljivostne reakcije.
Čeprav se antibiotiki (kot sta penicilin in eritromicin) uporabljajo kot del zdravljenja bolnikov z davico, je hitra pasivna imunizacija z davičnim antitoksinom najučinkovitejša pri zmanjševanju smrtnosti. Dolga razpolovna doba specifičnega antitoksina v krvnem obtoku je pomemben dejavnik za zagotavljanje učinkovite nevtralizacije davičnega toksina; vendar mora antitoksin, da bi bil učinkovit, reagirati s toksinom, preden lahko vstopi v celico.
Preoblikovanje davičnega toksina za razvoj citotoksinov, specifičnih za evkariontske receptorje
Proteinski inženiring je novo in hitro razvijajoče se področje molekularne biologije; združuje metodologije rekombinantne DNK in sintezo DNK v trdni fazi za načrtovanje in konstruiranje himernih genov, katerih produkti imajo edinstvene lastnosti. Študije strukturno-funkcijskih odnosov davičnega toksina so jasno pokazale, da je ta toksin tridomenski protein: katalitski, transmembranski in receptorski. Nativno vezavno domeno davičnega toksina, ki se veže na receptor, je bilo mogoče genetsko nadomestiti z različnimi polipeptidnimi hormoni in citokini (npr. α-melanocite stimulirajoči hormon [α-MSH], interlevkin (IL) 2, IL-4, IL-6, IL-7, epidermalni rastni faktor). Nastali himerni proteini ali fuzijski toksini združujejo specifičnost vezave citokina na receptor s transmembransko in katalitično domeno toksina. V vsakem primeru se je pokazalo, da fuzijski toksini selektivno zastrupljajo le tiste celice, ki nosijo ustrezen ciljni receptor. Prvi od teh gensko spremenjenih fuzijskih toksinov, DAB 389IL-2, se trenutno ocenjuje v kliničnih preskušanjih na ljudeh za zdravljenje refraktornih limfomov in avtoimunskih bolezni, pri katerih imajo celice z visoko afiniteto za receptorje IL-2 pomembno vlogo pri patogenezi.[ 7 ] Izkazalo se je, da je uporaba DAB 389 IL-2 varna, dobro prenašana in sposobna povzročiti trajno remisijo bolezni brez resnih stranskih učinkov. Verjetno bodo fuzijski toksini na osnovi davičnega toksina postali pomembna nova biološka sredstva za zdravljenje specifičnih tumorjev ali bolezni, pri katerih je mogoče ciljati na specifične receptorje na celični površini.


 [
[