Medicinski strokovnjak članka
Nove publikacije
Steklina pri otrocih
Zadnji pregled: 04.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Steklina ali hidrofobija je akutna virusna bolezen, ki se prenaša z ugrizom okužene živali, s poškodbo živčnega sistema in razvojem hudega encefalitisa s smrtnim izidom.
Epidemiologija
Virus stekline, ki je že od antičnih časov nadloga javnega zdravja, trenutno vsako leto povzroči približno 59.000 človeških smrti, skoraj vse pa se prenašajo s pasjimi ugrizi. To ima znaten gospodarski vpliv na države v razvoju, zlasti v Afriki in Aziji, ki lahko prenesejo najmanj takšnih izgub. Kljub skoraj 100-odstotni stopnji smrtnosti pa je steklina pri psih bolezen, ki jo je mogoče v celoti preprečiti, kar potrjujejo zgodovinski primeri izkoreninjenja stekline pri psih v razvitem svetu. [ 1 ]
Vzroki steklina
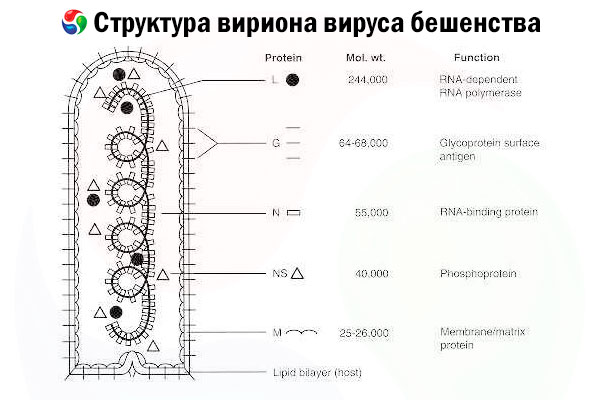
Povzročitelj je virus stekline (RV), negativno verižni RNA virus iz družine rabdovirusov, velik približno 60 nm × 180 nm.
Sestavljen je iz notranjega proteinskega jedra ali nukleokapside, ki vsebuje nukleinsko kislino, in zunanje membrane, lipidno vsebujočega dvojnega sloja, prekritega s transmembranskimi glikoproteinskimi konicami. Ima relativno preprosto modularno strukturo genoma in kodira pet strukturnih proteinov:
- RNA-odvisna RNA polimeraza (L),
- nukleoprotein (N),
- fosforilirani protein (P),
- matrični protein (M) in
- glikoprotein zunanje površine (G).
Proteini N, P in L skupaj z genomsko RNA tvorijo ribonukleoproteinski kompleks. G je edini antigen RV, ki lahko sproži nastanek nevtralizirajočih protiteles proti RV, ki so glavni imunski efektorji proti smrtonosni okužbi z RV. Po drugi strani pa se je izkazalo, da je ribonukleoproteinski kompleks glavni antigen RV, ki lahko sproži nastanek celic CD4+ T, kar lahko poveča nastanek nevtralizirajočih protiteles proti RV z intrastrukturnim prepoznavanjem antigena.[ 2 ] Ribonukleoproteinski kompleks ima lahko pomembno vlogo pri vzpostavljanju imunološkega spomina in dolgoročne imunosti.[ 3 ]
Klasifikacija in vrste antigenov
Rod Lyssavirus vključuje virus stekline in antigensko ter genetsko sorodne viruse stekline: viruse netopirjev Lagos, Mokola in Duvenhage, pa tudi dva domnevna podtipa evropskih virusov netopirjev. Študije navzkrižne zaščite kažejo, da živali, imunizirane s tradicionalnimi cepivi proti steklini, morda niso popolnoma zaščitene, če so izpostavljene drugim virusom stekline.
Viruse stekline lahko razdelimo na fiksne (prilagojene s pasažo v živalih ali celični kulturi) ali ulične (divji tip). Uporaba monoklonskih protiteles in genetskega sekvenciranja za razlikovanje uličnih virusov stekline je pomagala pri prepoznavanju virusnih variant, ki izvirajo iz glavnih rezervoarjev gostiteljev po vsem svetu, in pri predlaganju verjetnih virov izpostavljenosti ljudi, kadar v bolnikovem primeru sicer ni bilo zgodovine dokončnega ugriza živali.[ 8 ]
Patogeneza
Glavni rezervoar in vir okužbe med divjimi živalmi so volkovi, lisice, šakali, netopirji, med domačimi živalmi pa psi in mačke, redko konji, govedo, prašiči, podgane itd. Prenos okužbe z osebe na osebo je sicer možen, vendar izjemno redek. To je tipična zoonotska okužba. Ljudje se okužijo s steklino predvsem od psov.
Ko človeka ugrizne bolna žival, se virus razmnoži v mišičnem tkivu na mestu ugriza in se nato, ko doseže konce senzoričnih perifernih živcev, centripetalno širi do motoričnih nevronov. Čas, potreben za gibanje virusa in prizadetost možganov, je odvisen od mesta ugriza. V primeru hudih ugrizov glave in obraza lahko virus doseže centralni živčni sistem v 15–20 dneh, v primeru manjših poškodb kože trupa in okončin ter posledično majhnega odmerka patogena pa se lahko proces premikanja virusa v centralni živčni sistem zavleče za več mesecev ali celo do 1–1,5 leta. Ko virus doseže centralni živčni sistem, se fiksira v tkivih možganov in hrbtenjače, predvsem v nevronih podolgovate hrbtenjače, Ammonovega roga in baze možganov. V hrbtenjači so najbolj prizadeti zadnji rogovi. Iz osrednjega živčnega sistema virus centrifugalno po živčnih deblih doseže slinaste žleze, kjer se razmnožuje in izloča s slino.
Koncepti patogeneze stekline
Virus stekline (RV) ima širok nabor gostiteljev in lahko okuži skoraj vse sesalce. Čeprav je bilo poročanih o več poteh prenosa RV, se naravna okužba najpogosteje zgodi z ugrizom. Poleg ugrizov lahko uživanje trupel, okuženih z RV, spodbudi okužbo z virusom stekline pri arktičnih lisicah, stik RV s sluznicami pa je bila še ena možna pot prenosa.[ 9 ] V nekaterih nenavadnih okoliščinah, kot je nenamerno sproščanje RV kot aerosola v laboratoriju ali RV kot aerosola v jamah, kjer živi veliko število netopirjev,[ 10 ] lahko pride do prenosa aerosola.
Še ni jasno, ali se ulični sevi RV in sevi RV, prilagojeni mišim ali tkivnim kulturam, replicirajo na mestu inokulacije, preden vstopijo v osrednje živčevje. Medtem ko je eksperimentalna intramuskularna okužba mladih hrčkov ali rakunov z uličnim RV pokazala replikacijo RV v celicah progastih mišic, preden je virus napadel aksone motoričnih nevronov preko nevromuskularnih stikov,[ 11 ],[ 12 ] je intramuskularna okužba miši z mišjem prilagojenim CVS-24 RV pokazala, da RV migrira neposredno v osrednje živčevje brez predhodne replikacije na mestu inokulacije.[ 13 ] Ko je RV enkrat v terminalih nemieliniziranih aksonov, se retrogradno prenese v telo celice.
Nedavne ugotovitve kažejo, da lahko transport aksonskih veziklov predstavlja ključno strategijo za premikanje virionov na dolge razdalje v aksonih.[ 14 ] Ocenjeno je, da RV migrira znotraj aksonov s hitrostjo 3 mm/h.[ 15 ] Okužba se nato širi skozi verigo nevronov, povezanih s sinaptičnimi stiki. Vendar natančen mehanizem, ki spodbuja transsinaptično širjenje, še ni znan. Po okužbi možganov se virus centrifugalno širi v periferni in avtonomni živčni sistem v številnih perifernih organih.[ 16 ] V zadnji fazi okužbe se RV preseli v žleze slinavke; po replikaciji v mukogenih acinarnih celicah se sprosti v slino in je pripravljen za prenos na naslednjega gostitelja.[ 17 ]
Glede patologije, ki jo povzroča virus stekline, je bila apoptotična celična smrt predlagana kot potencialni patogeni mehanizem v eksperimentalnih modelih stekline pri miših, okuženih s fiksnim sevom RV.[ 18 ] Patogeni mehanizem, ki lahko prispeva k hudi disfunkciji osrednjega živčevja, značilni za steklino, je lahko okvarjena nevronska funkcija. Izražanje genov je bilo v nevronih, okuženih z RV, izrazito zmanjšano, kar povzroči splošno zaviranje sinteze beljakovin,[ 19 ] in več študij je pokazalo okvarjeno nevrotransmisijo po okužbi z RV. Jiang je dokazal, da je bila vezava antagonista acetilholinskih receptorjev na okužene homogenate možganov podgan zmanjšana v primerjavi s kontrolno skupino.[ 20 ] V možganih podgan, okuženih z RV, so opazili tudi okvarjeno sproščanje in vezavo serotonina, nevrotransmiterja, ki sodeluje pri nadzoru cikla spanja, zaznavanja bolečine in vedenja.[ 21 ], [ 22 ] Poleg vpliva na nevrotransmisijo lahko okužba desnega prekata vpliva tudi na ionske kanale. Okužene mišje celice nevroblastoma kažejo zmanjšano funkcionalno izražanje napetostno odvisnih natrijevih kanalov, kar lahko prepreči akcijske potenciale in na koncu privede do funkcionalne okvare. [ 23 ]
Poleg odsotnosti resnih patoloških lezij v osrednjem živčevju večina primerov stekline pri ljudeh ne izzove imunskega odziva 7 do 10 dni po pojavu kliničnih znakov. Te velike razlike med patogenezo stekline in patogenezo večine drugih virusnih ali bakterijskih okužb osrednjega živčevja dodatno podpira dejstvo, da je imunosupresija bodisi neučinkovita bodisi škodljiva za izid stekline.[ 24 ] Nizka raven imunskega odziva, ki jo pogosto opazimo pri žrtvah stekline, je zmedena, ker je ni mogoče razložiti s slabo imunogenostjo antigenov RV. Pravzaprav sta RV G in nukleokapsidni protein močna antigena B- in T-celic, če ju dajemo parenteralno.[ 25 ] Možna razlaga za nizko stopnjo imunskega odziva proti RV pri ljudeh ali živalih s steklino je lahko ta, da okužba osrednjega živčevja z RV povzroča imunosupresijo,[ 26 ] in predlagano je bilo, da RV uporablja subverzivno strategijo, vključno s preprečevanjem apoptoze in uničevanjem invazivnih celic T.[ 27 ]
Oslabljeni sevi RV, ki so bili prilagojeni na ne-nevronske celice, se bistveno razlikujejo od patogenih sevov uličnega RV po svoji nevroinvazivnosti, ki se nanaša na njihovo sposobnost vdora v CNS s perifernih mest. V zvezi s tem sevi RV, prilagojeni na tkivne kulture, bodisi nimajo bodisi imajo le omejeno sposobnost vdora v CNS s perifernih mest, medtem ko so sevi uličnega RV ali sevi RV, prilagojeni na miši, kot je CVS-24, zelo invazivni.[ 28 ] Ključni dejavniki, ki sodelujejo pri nevroinvaziji RV, vključujejo privzem virusa, aksonski transport, transsinaptično širjenje in hitrost virusne replikacije.
Do nedavnega je bilo naše znanje o patogenezi RV omejeno in je temeljilo predvsem na deskriptivnih študijah uličnih sevov RV ali eksperimentalnih okužb z oslabljenimi sevi, prilagojenimi v laboratoriju. Pojav tehnologije reverzne genetike nam je omogočil identifikacijo virusnih elementov, ki določajo patogeni fenotip RV, in boljše razumevanje mehanizmov, vključenih v patogenezo stekline.
Identifikacija virusnih elementov, ki nadzorujejo pridobivanje, širjenje in replikacijo virusa stekline
- Virusni elementi, vključeni v zajemanje virusa
Okužba z RV se začne z vezavo virusa na domnevni celični receptor. Čeprav je bilo kot receptorje RV predlaganih več molekul na površini membrane, vključno z nikotinskim acetilholinskim receptorjem,[ 29 ] adhezijsko molekulo nevronskih celic[ 30 ] in nizkoafinitetnim nevrotrofinskim receptorjem p75 NTR,[ 31 ] še vedno ni jasno, ali te molekule dejansko igrajo vlogo v življenjskem ciklu virusa stekline. V tem kontekstu je bilo nedavno dokazano, da interakcija RV G–p75 NTR ni potrebna za okužbo primarnih nevronov z RV.[ 32 ] Po vezavi na receptor se RV internalizira preko adsorptivne ali receptorsko posredovane endocitoze.[ 33 ] Okolje z nizkim pH v endosomskem predelu nato povzroči konformacijske spremembe v RV G, ki sprožijo fuzijo virusne membrane z endosomsko membrano, s čimer se sprosti RNP v citoplazmo.[ 34 ] Pri virusih ima RV G ključno vlogo pri privzemu virusa, najverjetneje prek interakcij z domnevnimi celičnimi receptorji, ki omogočajo hiter privzem. V zvezi s tem je bilo dokazano, da patogenost sevov RV, prilagojenih tkivni kulturi (npr. ERA, HEP in CVS-11), korelira s prisotnostjo determinante, ki se nahaja na antigenskem mestu III proteina G. [ 35 ] Mutacija Arg → Gln na položaju 333 na tem antigenskem mestu proteina G ERA je povzročila sedemkratno zakasnitev internalizacije variante Gln333 RV v primerjavi z varianto divjega tipa. Mutacija Asn194→Lys194 v RV G, ki pojasnjuje ponovni pojav patogenega fenotipa, je bila povezana s pomembnim zmanjšanjem časa internalizacije.[ 36 ] Poleg tega so poskusi s himernimi RV pokazali, da se je čas, potreben za internalizacijo virionov RV, znatno povečal in patogenost močno zmanjšala po zamenjavi gena G visoko patogenega seva SB RV, ki je izhajal iz klona cDNA seva RV-18, povezanega z netopirjem, pridobljenega iz srebra,[ 37 ] z genom visoko oslabljenega seva SN, ki je bil izoliran iz klona cDNA cepivnega seva SAD B19 RV.[ 38 ] Ti podatki skupaj podpirajo idejo, da je kinetika privzema virusa, ki je funkcija RV G, glavni dejavnik patogenosti RV.
- Virusni elementi, ki sodelujejo pri širjenju in prenosu virusov
Edinstvena lastnost virusa stekline je njegova sposobnost širjenja iz celice v celico. Opazovanje, da varianta Gln333 ERA in vitro izgubi pH-odvisno aktivnost celične fuzije [ 39 ] in kaže močno zmanjšano sposobnost širjenja iz celice v celico [ 40 ], kaže, da ima RV G tudi ključno vlogo pri širjenju iz celice v celico in s tem pri prenosu virusa, verjetno zaradi svoje fuziogene aktivnosti. To možnost dodatno podpira ugotovitev, da je stopnja širjenja patogenega revertantnega RV SPBNGAK skoraj dvakrat višja od stopnje, določene za nepatogeno varianto SPBNGA. Zanimivo je, da je mutacija Asn 194 → Lys 194 v G SPBNGAK povzročila premik praga pH za membransko fuzijo na višji pH, kar podpira hipotezo, da je višji prag pH za membransko fuzijo povezan s povečanim širjenjem virusa. [ 41 ]
Študije transnevronskih indikatorjev okužbe z RV pri podganah [ 42 ] in rezus opicah [ 43 ] so pokazale, da virus stekline migrira izključno v retrogradni smeri v aksonih. Čeprav je več proteinov RV vključenih v mehanizme nevronskega transporta, se zdi, da ima RV G prevladujočo vlogo pri transnevronalnem širjenju okužbe z RV. Na primer, medtem ko periferna okužba z virusom infekcijske anemije konj (EIAV), psevdotipiziranim z RV G, povzroči prenos virusa v hrbtenjačo, isti EIAV, psevdotipiziran z virusom vezikularnega stomatitisa G, ni vstopil v živčni sistem. [ 44 ] Poleg tega je bilo ugotovljeno, da je širjenje virusa mutanta ERA G Arg 333 → Gln 333 v osrednjem živčevju močno zmanjšano v primerjavi z mutantom divjega tipa, kar dodatno kaže na funkcijo intaktnega RV G pri transsinaptičnem širjenju. Vendar pa najbolj prepričljiv dokaz za pomembno vlogo RV G pri transsinaptičnem transportu izvira iz intrakranialne okužbe miši z rekombinantnim virusom RV s pomanjkanjem G, ki je pokazala, da je okužba ostala omejena na nevrone na mestu inokulacije brez kakršnih koli dokazov o širjenju na sekundarne nevrone.[ 45 ] Vendar je verjetno, da poleg RV G tudi RV M igra vlogo pri širjenju virusa in s tem pri transsinaptičnem transportu. V zvezi s tem je bilo dokazano, da je bilo širjenje himerne variante SN-BMBG RV, ki vsebuje tako M kot G iz visoko patogenega SB, bistveno večje kot širjenje himerne variante SN-BG ali SN-BM, ki vsebujeta G oziroma M iz SB, kar kaže na to, da lahko optimalna interakcija M z G igra pomembno vlogo pri širjenju virusa iz celice v celico.[ 46 ] Ker RV M podpira brstenje virusa,[ 47 ] je verjetno, da je učinkovitejše širjenje himerne variante RV SN-BMBG posledica optimalnega brstenja virusa na postsinaptični membrani.
Nedavne študije so pokazale, da interakcija med RVP in lahko verigo dineina povezuje RV RNP s transportnim sistemom gostiteljske celice, s čimer olajša retrogradni aksonski transport virusa.[ 48 ],[ 49 ] Vendar pa je periferna okužba odraslih miši pokazala, da delecija vezavne domene LC8 RVP ne prepreči vstopa virusa v CNS, kar kaže na to, da RV protein ni neposredno vključen v retrogradno aksonsko širjenje RV.[ 50 ]
- Virusni elementi, ki nadzorujejo virusno replikacijo
Za razliko od mnogih drugih virusov, kot je virus gripe, je patogenost RV obratno sorazmerna s hitrostjo sinteze virusne RNA in produkcije infekcijskih virusnih delcev. Primerjava ravni virusne mRNA in genomske RNA, ki jo proizvajajo različni himerni virusi, kaže, da transkripcijo in replikacijo virusne RNA uravnava več dejavnikov, vključno z RV M, ki je bil identificiran kot transaktivni faktor, ki posreduje pri prehodu z začetnih visokih ravni sinteze mRNA na sintezo genomske RNA.[ 51 ] Poleg tega je M iz vseh rabdovirusov sposoben izklopiti izražanje virusnih genov z vezavo na RNP, kar povzroči nastanek zelo kondenzirane strukture, podobne hrbtenici, ki ne more podpirati sinteze RNA.
Za identifikacijo drugih virusnih elementov, ki nadzorujejo patogenost z uravnavanjem virusne replikacije, so bila 5' terminalna zaporedja visoko patogenega seva SB postopoma nadomeščena z zaporedji iz visoko oslabljenega cepivnega seva SN, kar je povzročilo rekombinantne viruse SB2 (terminalno zaporedje [TS] + L), SB3 (TS + L + psevdogen [Ψ]), SB4 (TS + L + Ψ + G) in SB5 (TS + L + Ψ + G + M). Intramuskularna okužba s starševskimi virusi SB in SN ter himernimi RV SB2, SB3, SB4 in SB5 je povzročila najvišje stopnje umrljivosti pri miših, okuženih s SB, in nobene obolevnosti ali umrljivosti pri miših, okuženih s SN. Zamenjava TS, L in SB z ustreznimi elementi iz SN je povzročila zmerno zmanjšanje obolevnosti in umrljivosti, dodatna izmenjava G ali G plus M pa je močno zmanjšala ali popolnoma odpravila virusno patogenost.
Fenotipska karakterizacija teh divjega tipa in himernih RV v tkivni kulturi je pokazala, da je patogenost danega RV obratno sorazmerna z njegovo sposobnostjo replikacije v nevronskih celicah. Čeprav se je SB repliciral na ravneh, ki so bile skoraj 1000-krat nižje od SN, in je zamenjava TS, L in v SB z ravnmi SN imela majhen vpliv na kinetiko rasti virusa, je dodatna zamenjava G ali G plus M v SB z ustreznimi geni SN povzročila 1-logaritemsko povečanje produkcije virusa, kar kaže na to, da kinetiko replikacije virusne RNA in produkcijo virusnih delcev v veliki meri nadzira protein G RV. Ta sklep podpirajo podatki, pridobljeni z variantami G RV, ki se v svojih proteinih G razlikujejo za eno aminokislino. Patogena varianta virusa stekline SPBNGAK 194 je v celicah NA povzročila titer virusa, ki je bil za 1 log nižji od tistega, ki ga je povzročila nepatogena varianta SPBNGAN 194, analiza PCR v realnem času pa je pokazala, da so bile stopnje transkripcije in replikacije virusne RNA v celicah NA, okuženih s SPBNGAK, 5- in 10-krat višje kot v celicah NA, okuženih s SPBNGAK.[ 52 ] Nadaljnje dokaze za obratno korelacijo med patogenostjo in hitrostjo sinteze virusne RNA ter produkcijo virusnih delcev so zagotovile miši, okužene s himernimi rekombinantnimi virusi, pri katerih so bili geni G in M oslabljenega seva SN nadomeščeni z geni visoko patogenega seva SB. Ti poskusi so pokazali znatno povečanje patogenosti starševskega seva SN, ki je nosil RV G, v primerjavi s patogenim sevom SB. Patogenost se je še povečala, ko sta bila v SN vnesena tako G kot M iz SB.
Zamenjava G ali M ali obeh v SN z ustreznimi geni iz SB je bila povezana s pomembnim zmanjšanjem hitrosti nastajanja virusnih delcev in hitrosti sinteze virusne RNA. Ti podatki kažejo, da imata tako G kot M pomembno vlogo pri patogenezi RV z uravnavanjem virusne replikacije. Ugotovitev, da zamenjava G ali G plus M v SN z G ali G plus M iz SB povzroči zmerno do močno zmanjšanje transkripcije oziroma replikacije virusne RNA, medtem ko zamenjava samega M v SN z M iz SB povzroči močno povečanje transkripcije in replikacije virusne RNA, kaže, da ima RV G tudi pomembno regulatorno funkcijo pri transkripciji/replikaciji virusne RNA, bodisi sam bodisi prek interakcije z proteinom M. Mehanizem, s katerim gen RV G nadzoruje sintezo virusne RNA, ni znan. Določena nukleotidna zaporedja znotraj genov RV G, kot so tista, ki vključujejo kodona za Arg333 in Lys 194, so bila identificirana kot tarče za celične miRNA. Dokazano je, da lahko prepoznavanje tarč s strani celičnih miRNA povzroči pozitivno ali negativno regulacijo virusne replikacije. [ 53 ] Zamenjave Arg 333 → Glu 333 ali Lys 194 → Ser 194 znotraj zaporedja gena RV G povzročijo odpravo ciljnih zaporedij miRNA, kar je posledično povezano s pomembnim povečanjem hitrosti sinteze virusne RNA [Faber M, Univerza Thomas Jefferson, PA, ZDA, neobjavljeni podatki], kar kaže na to, da imajo miRNA v gostiteljskih celicah pomembno vlogo tudi pri regulaciji replikacije RV, kot je bilo dokazano pri drugih RNA virusih, vključno z virusom vezikularnega stomatitisa in HCV. [ 54 ], [ 55 ]
Zdi se, da je regulacija virusne replikacije eden pomembnih mehanizmov, vključenih v patogenezo RV. Da bi se izognili imunskemu odzivu in ohranili celovitost nevronskega omrežja, lahko patogeni sevi RV, ne pa tudi oslabljeni sevi, uravnavajo svojo hitrost rasti. Nižja stopnja replikacije verjetno koristi patogenim sevom RV, saj ohranja nevronsko strukturo, ki jo ti virusi uporabljajo za dosego osrednjega živčevja. Druga razlaga za nižjo stopnjo replikacije patogenega RV je, da virus, da bi se izognil zgodnjemu odkrivanju s strani gostiteljevega imunskega sistema, ohranja minimalno raven izražanja svojih antigenov.
Razmerje med izražanjem RV G, apoptozo in patogenostjo
Dobro je znano, da sevi virusa stekline, ki so bistveno bolj patogeni kot sevi, prilagojeni tkivnim kulturam, izražajo zelo omejene ravni G in ne povzročajo apoptoze do pozne faze infekcijskega cikla, kar kaže na to, da je patogenost določenega virusnega seva obratno sorazmerna z izražanjem RV G in sposobnostjo indukcije apoptoze.[ 56 ] Neposredni dokazi za korelacijo med stopnjo izražanja G in obsegom apoptoze so bili pridobljeni z rekombinantnim RV SPBNGA-GA, ki je nosil dva identična gena G in prekomerno izražal RV G.[ 57 ] Morfološke študije nevronskih kultur, okuženih s tem rekombinantnim RV, so pokazale, da se je celična smrt znatno povečala vzporedno s prekomernim izražanjem RV G in da je apoptoza glavni mehanizem, ki sodeluje pri smrti, ki jo posreduje RV G. Zlasti zmanjšanje obarvanja F-aktina po okužbi s SPBNGA-GA je skladno z apoptozo inducirano depolimerizacijo aktinskih filamentov. Poleg tega se je število TUNEL-pozitivnih jeder v nevronih, okuženih s SPBNGA-GA, znatno povečalo v primerjavi z neokuženimi in s SPBNGA okuženimi nevroni. Vendar pa mehanizem, s katerim gen RV G posreduje v procesu apoptotične signalizacije, ostaja v veliki meri neznan. Domneva se, da izražanje RV G nad določenim pragom močno poruši celično membrano. Zelo verjetno je, da se apoptotične celice v CNS ne odstranijo hitro in zato doživijo sekundarno nekrozo. [ 58 ] Po drugi strani pa lahko okužba z RV in zlasti prekomerno izražanje proteina RV G povzroči piroptozo, pot celične smrti, podobno apoptozi, ki za razliko od apoptoze vključuje aktivacijo kaspaze 1 in s tem vodi v nekrozo. [ 59 ] Stopnja nekroze ali piroptoze, ki jo povzroči okužba z RV, verjetno igra ključno vlogo pri indukciji protivirusne imunosti. Medtem ko apoptotične celice ohranjajo celovitost membrane in ne spodbujajo prirojenega imunskega odziva, nekrotične celice postanejo permeabilne in izločajo endogene adjuvanse, ki lahko sprožijo močan prirojeni imunski odziv. [ 60 ]
Ker je raven apoptoze/nekroze povezana z imunogenostjo RV, se domneva, da imunostimulacijski učinek apoptotičnih/nekrotičnih celic najverjetneje prispeva k nastanku zaščitnega imunskega odziva. Zato je regulacija izražanja RV G zelo verjetno pomemben dejavnik pri patogenezi stekline, saj omogoča preživetje in razširjanje patogenih variant RV v živčnem sistemu, ne da bi pri tem povzročila očitne poškodbe nevronov, in izzove zaščitni imunski odziv, ki bi preprečil okužbo.
Izražanje RV G je lahko regulirano na ravni sinteze RNA, posttranslacijski ravni ali na obeh. Pokazalo se je, da se ravni RV G, ki jih izražajo različne himerne variante RV, odražajo v hitrosti sinteze virusne RNA, kar kaže na to, da različna regulacija izražanja RV G s temi variantami izhaja iz razlik v hitrosti transkripcije virusne mRNA. Tako kot pri hitrostih transkripcije virusne RNA je količina RV G, ki jo izražajo te variante, obratno sorazmerna z virusno patogenostjo. Po drugi strani pa je okužba primarnih nevronskih kultur z manj patogeno varianto RV CVS-B2c povzročila štirikrat višje ravni G proteina kot okužba z visoko patogeno varianto CVS-N2c, kljub sintezi primerljivih ravni G mRNA pri obeh okužbah. Poskusi s pulznim zasledovanjem so pokazali, da so bile višje ravni G proteina v nevronih, okuženih s CVS-B2c, v veliki meri posledica nižje stopnje razgradnje G proteina CVS-B2c v primerjavi z G proteinom CVS-N2c. Vendar pa mehanizem, ki vodi do hitrejše proteolitične razgradnje proteina CVS-N2c G, še ni pojasnjen.
Simptomi steklina
Inkubacijska doba za steklino je v povprečju 30–90 dni. V primeru obsežne okužbe skozi velike rane na glavi in obrazu se lahko skrajša na 12 dni. V redkih primerih lahko inkubacijska doba traja 1 leto ali več.
Obstaja strogo zaporedna sprememba treh obdobij bolezni: prodromalnega, vzbujenega, paralize.
Prodromalno obdobje se začne s pojavom boleče ali vlečne bolečine na mestu ugriza, pa tudi bolečine vzdolž živcev. V predelu brazgotine se lahko pojavi pekoč občutek, srbenje, včasih rdečina in oteklina. Bolnik občuti splošno slabo počutje, glavobol, slabost. Opažene so bruhanje, zvišanje telesne temperature na 37,5-38 °C in simptomi progresivne duševne motnje: povečana refleksna razdražljivost, nerazložljiv občutek tesnobe, strahu, melanholije. Pogosto je bolnik depresiven, zadržan, zaprt vase, noče jesti, slabo spi, se pritožuje nad mračnimi mislimi, strašljivimi sanjami. Prodromalno obdobje traja 2-3 dni, včasih se podaljša na 7 dni. Ob koncu tega obdobja se lahko pojavijo napadi tesnobe s kratkotrajnimi težavami z dihanjem, občutkom tiščanja v prsih, ki ga spremljata tahikardija in povečana frekvenca dihanja.
Obdobje vznemirjenja zaznamuje pojav hidrofobije: ko poskuša piti, nato pa že ob pogledu na vodo ali spominu nanjo bolnik doživi konvulzivni krč žrela in grla, med katerim z krikom vrže stran vrček vode, vrže naprej tresoče se roke, vrže nazaj glavo in telo. Vrat je iztegnjen, boleča grimasa popači obraz, ki zaradi krča dihalnih mišic postane modrikast. Oči izbuljijo, izražajo strah, prosijo za pomoč, zenice so razširjene, vdih je otežen. Na vrhuncu napada je možen srčni in dihalni zastoj. Napad traja nekaj sekund, po katerem se bolnikovo stanje zdi, da se izboljša. Kasneje se lahko pojavijo napadi krčev mišic grla in žrela tudi zaradi gibanja zraka (aerofobija), močne svetlobe (fotofobija) ali glasne besede (akustikofobija). Napade spremlja psihomotorična vznemirjenost, med katero se bolnik obnaša kot "norec". Med napadom je zavest zamegljena, v interiktalnem obdobju pa se zjasni. V obdobju vznemirjenosti se pri bolnikih zaradi povečanega tonusa simpatičnega živčnega sistema pojavi močno povečano slinjenje (sialoreja) z nezmožnostjo požiranja sline zaradi krča faringealnih mišic. Bolnik prši slino. Pri nekaterih bolnikih se lahko pojavijo znaki meningizma in celo opistotonusa, pogosti so tudi krči. V tem primeru se cerebrospinalna tekočina morda ne spremeni, pri nekaterih bolnikih pa se lahko poveča koncentracija beljakovin in število celic zaradi limfocitov.
Brez ustreznega zdravljenja se znaki dehidracije stopnjujejo, obrazne poteze postanejo ostrejše, telesna teža pa se zmanjša. Telesna temperatura se dvigne do visokih vrednosti. Možni so krči. Trajanje faze vzbujanja je približno 2-3 dni, redko 4-5 dni. Smrtni izid se običajno pojavi med enim od napadov. Redko bolnik preživi do tretje faze bolezni.
Med obdobjem paralize se bolnik umiri. Napadi hidrofobije prenehajo, bolnik lahko pije in pogoltne hrano, zavest je jasna. Vendar se kljub navideznemu dobremu počutju stopnjujejo letargija, apatija, depresija, paraliza okončin, medenične motnje in kmalu se pojavijo paraliza možganskih živcev. Telesna temperatura se dvigne na 42–43 °C, arterijski tlak pade in do konca prvega dne nastopi smrt zaradi paralize kardiovaskularnega in dihalnega centra.
V periferni krvi opazimo nevtrofilno levkocitozo, povišan hemoglobin, eritrocite in hematokrit.
Kaj te moti?
Obrazci
Klinično ločimo tipične in atipične oblike. Atipične oblike vključujejo vse primere brez vzburjenja in hidrofobije. Atipične oblike vključujejo bulbarno, cerebelarno, meningoencefalitično itd.
Diagnostika steklina
Diagnozo stekline lahko postavimo z odkrivanjem antigena stekline, protiteles, virusne RNA ali izolacijo virusa. Ker je lahko pri bolniku s steklino kateri koli posamezen test negativen, so včasih potrebni serijski vzorci seruma za odkrivanje protiteles proti steklini, vzorci sline za virusno kulturo in biopsija kože za neposredno imunofluorescenčno testiranje na virusni antigen, zlasti kadar obstaja velik sum na steklino.
Ena najhitrejših metod za diagnosticiranje stekline pred smrtjo pri ljudeh je izvedba direktnega imunofluorescenčnega testa na biopsiji kože na zatilju za odkrivanje antigena stekline. Direktni imunofluorescenčni test je najbolj občutljiva in specifična metoda za odkrivanje antigena stekline v koži in drugih svežih tkivih (npr. biopsija možganov), čeprav so rezultati lahko občasno negativni na začetku bolezni. Če sveže tkivo ni na voljo, lahko encimska razgradnja fiksiranih tkiv poveča reaktivnost imunofluorescenčnega testa; vendar je lahko občutljivost nesprejemljivo nizka.
Diagnozo je mogoče postaviti tudi, če virus izoliramo iz sline po inokulaciji celic nevroblastoma ali laboratorijskih glodalcev; to je običajno najučinkovitejše v prvih 2–3 tednih bolezni. Diagnostična je tudi detekcija protiteles, ki nevtralizirajo virus stekline, običajno izvedena s hitrim fluorescentnim fokusnim inhibicijskim testom (RFFIT), v serumu necepljenih posameznikov. Prisotnost protiteles v cerebrospinalni tekočini potrdi diagnozo, vendar se lahko pojavijo 2–3 dni pozneje kot serumska protitelesa in so zato v zgodnjih fazah bolezni manj uporabna. Medtem ko serološki odziv po cepljenju na splošno ni mogoče razlikovati od serološkega odziva, ki ga povzroči bolezen, cepljenje običajno ne povzroči protiteles proti cerebrospinalni tekočini.
V zadnjih 25 letih je bilo dobro dokumentiranih le sedem primerov "okrevanja" od stekline. Čeprav virus stekline ni bil izoliran pri nobenem od bolnikov, so visoki titri protiteles, ki nevtralizirajo steklino, v vzorcih seruma in prisotnost nevtralizirajočih protiteles v cerebrospinalni tekočini močno podpirali diagnozo.
Kaj je treba preveriti?
Katere teste so potrebne?
Diferencialna diagnoza
Diagnoza stekline pri ljudeh se običajno postavi na podlagi epidemioloških in kliničnih podatkov ter potrdi v laboratoriju. Diagnoza je enostavna, če obstaja anamneza ugrizov živali in se je pojavil celoten spekter simptomov in znakov. V nasprotnem primeru je pred izvedbo specifičnih laboratorijskih preiskav potrebna skrbna, a hitra ocena epidemioloških in kliničnih značilnosti manj tipičnih primerov. Vsakega bolnika z nevrološkimi znaki ali simptomi ali nepojasnjenim encefalitisom je treba vprašati o možnosti izpostavljenosti živalim na območjih, endemičnih za steklino, znotraj ali zunaj države stalnega prebivališča. Razlog za to, da v več nedavnih smrtnih primerih ljudi v Združenih državah Amerike ni bilo mogoče posumiti na steklino, je lahko pomanjkanje skrbne anamneze izpostavljenosti.
Na začetku bolezni lahko steklina posnema številne nalezljive in nenalezljive bolezni. Številni drugi encefalitisi, kot so tisti, ki jih povzročajo herpesvirusi in arbovirusi, so podobni steklini. Tudi druge nalezljive bolezni lahko posnemajo steklino, kot so tetanus, cerebralna malarija, rikecioza in tifus. Paralitične nalezljive bolezni, ki jih je mogoče zamenjati s steklino, vključujejo poliomielitis, botulizem in herpes simian B encefalitis.
Neinfekcijske bolezni, ki jih je mogoče zamenjati s steklino, vključujejo številne nevrološke sindrome, zlasti akutno vnetno polinevropatijo (Guillain-Barréjev sindrom), pa tudi alergijski encefalomielitis po cepljenju, ki je posledica cepljenja proti steklini v živčnem tkivu, zastrupitve ali zastrupitve z drogami, odtegnitvenih simptomov zaradi alkohola, akutne porfirije in histerije zaradi stekline. Guillain-Barréjev sindrom je mogoče zamenjati za paralitično steklino in obratno.
Koga se lahko obrnete?
Zdravljenje steklina
Zdravljenje stekline ni razvito. Dajanje velikih odmerkov specifičnega imunoglobulina proti steklini in levkocitnega interferona je neučinkovito. Za lajšanje bolnikovega trpljenja se izvaja simptomatsko zdravljenje. V ta namen se bolnik namesti v ločen oddelek ali boks, ustvari se zaščitni režim, ki omejuje vpliv zunanjega okolja (zmanjšan hrup, močna svetloba, pretok zraka). Za zmanjšanje razdražljivosti osrednjega živčnega sistema se predpišejo uspavala, antikonvulzivi in zdravila proti bolečinam. Vodna bilanca se normalizira.
V paralitični fazi se predpisujejo zdravila, ki spodbujajo delovanje srčno-žilnega in dihalnega sistema. Priporočljiva je hiperbarična oksigenacija, cerebralna hipotermija, nadzorovano mehansko dihanje s popolno kurarizacijo bolnika. Vendar so vse metode zdravljenja praktično neučinkovite. V najboljšem primeru je mogoče podaljšati bolnikovo življenje za več mesecev. Neugoden izid je vnaprej določen z resnostjo poškodbe možganskega debla z uničenjem vitalnih centrov.
Preprečevanje
Razvoj prvega cepiva proti steklini, ki ga je leta 1885 razvil Pasteur, je napovedal obdobje veliko učinkovitejšega nadzora nad steklino. Danes je kljub skoraj 100-odstotni stopnji umrljivosti ljudi zaradi stekline bolezen popolnoma preprečljiva s cepljenjem pred in/ali po izpostavljenosti. Medtem ko sta Pasteur in njegovi kolegi začela cepljenje zasebnih psov v Parizu, je bilo prvo množično cepljenje psov izvedeno v zgodnjih dvajsetih letih 20. stoletja na Japonskem, kar je pomenilo prvi večji nacionalni program nadzora nad steklino. Peroralno cepljenje divjih živali, ki je bilo prvič razvito v sedemdesetih letih 20. stoletja, se je od takrat večkrat izkazalo za učinkovito pri nadzoru bolezni pri glavnih kopenskih gostiteljih, kot so lisice, rakuni in skunki.[ 68 ] Vztrajno cepljenje proti steklini populacij rezervoarnih živali s 70-odstotno ali višjo stopnjo pokritosti bo sčasoma odpravilo RABV iz rezervoarnih vrst in preprečilo širjenje virusa na naključne gostitelje.[ 69 ]
Filogenetski podatki kažejo, da so lisavirusi okužili netopirje že dolgo preden so okužili kopenske sesalce, večina lisavirusov, vključno z RABV, pa še vedno kroži v različnih vrstah netopirjev po vsem svetu.[ 70 ] Vendar pa učinkovite metode za preprečevanje prenosa RABV med netopirji ostajajo nedosegljive, kar trenutno onemogoča možnost popolnega izkoreninjenja stekline. Vendar pa lahko tudi po izpostavljenosti RABV prek ugriza sesalca, okuženega s steklino, varna in učinkovita postekspozicijska profilaksa (PEP, vključno s čiščenjem ran, imunskim globulinom proti steklini in cepljenjem proti steklini) zaščiti ljudi pred okužbo s steklino, če se zdravljenje izvede takoj in v skladu s priporočili Svetovne zdravstvene organizacije (WHO).
Ti dve metodi preprečevanja človeških smrti – ena temelji na cepljenju izpostavljenih ljudi in druga na cepljenju dovolj velikega števila psov, da se prekine cikel prenosa pri viru – sta gradnika pristopa »eno zdravje« k preprečevanju in obvladovanju stekline pri psih. Ta dva različna načina preprečevanja človeških smrti sta bila obravnavana kot ločeni alternativi: strategija A, ki temelji na zagotavljanju PEP ljudem, in strategija B, ki temelji na cepljenju psov; ali kot sestavni deli kombinirane strategije A + B v analizi verjetnih stroškov alternativnih strategij.[ 71 ]
Države, kot je Tajska, so dosegle ogromen uspeh pri preprečevanju smrti ljudi z uporabo PEP, vendar so ugotovile tudi naraščajoče povpraševanje in s tem povezane stroške, povezane z uporabo same PEP. [ 72 ] Na primer, v primerjavi z letom 1991 je leta 2003 PEP potrebovalo štirikrat več ljudi (več kot 400.000). Nedavni podatki kažejo, da Ljudska republika Kitajska, ki vsako leto cepi 15 milijonov ljudi po morebitni izpostavljenosti steklini, samo za PEP porabi približno 650 milijonov ameriških dolarjev na leto. [ 73 ]
Veliko bolj trajnosten pristop je preprečevanje širjenja okužbe pri viru, v živalski populaciji, hkrati pa povečanje dostopa do PEP za izpostavljene človeške paciente, kadar je to potrebno. Kjer obstaja politična volja in ustrezno financiranje za nadzor nad steklino pri psih, se lahko in so se smrtni primeri odpravili. Široka uporaba cepljenja psov je privedla do izkoreninjenja stekline pri psih v več državah, vključno z Malezijo leta 1954, [ 74 ] Japonsko leta 1956, Tajvanom leta 1961, Singapurjem in zlasti po vsej zahodni Evropi (pregledano v Rupprecht et al., King et al. ter Gongal in Wright). [ 75 ]
Использованная литература


 [
[