Medicinski strokovnjak članka
Nove publikacije
Virus humane imunske pomanjkljivosti (HIV)
Zadnji pregled: 23.04.2024

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Sindrom pridobljene imunske pomanjkljivosti je bil izoliran kot posebna bolezen v Združenih državah Amerike leta 1981, ko so pri številnih mladostnikih hude bolezni povzročili mikroorganizmi, ki so za zdrava ljudi nepatogeni ali rahlo patogeni. Preiskava imunskega stanja bolnikov je pokazala močno zmanjšanje števila limfocitov na splošno in zlasti T-pomočnikov. Ta pogoj se imenuje AIDS (sindrom pridobljene imunske pomanjkljivosti v angleščini - sindrom pridobljene imunske pomanjkljivosti ali AIDS). Metoda okužbe (spolni stik, prek krvi in njenih pripravkov) je pokazala nalezljivo naravo bolezni.
Vzroki za AIDS so odkrili leta 1983 neodvisno od Francoza L. Montagnierja, ki mu je ime LAV Lymphoadenopathy Associated Virus), ker je odkril bolnika z limfadenopatijo; in ameriški R. Gallo, ki je imenoval virus HTLV-III (angleški humani T-limfotropni virus III): prej so ga našli lymphotropic viruses I in II.
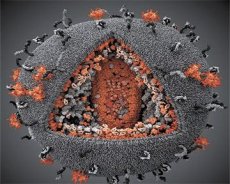
Primerjava lastnosti virusov LAV in HTLV-III je pokazala njihovo identiteto, zato se je leta 1986 virus imenoval HIV (virus humane imunske pomanjkljivosti ali HIV), da bi se izognili zmedi. HIV je sferičen, njegov premer je 110 nm. Ovojnica virusa ima obliko poliedra, sestavljenega iz 12 pentagonov in 20 šesterokotnikov. Molekula glikoziliranega proteina gpl20 se nahaja v sredini in vogalih vsakega šesterokotnika (številka 120 pomeni molekulsko maso proteina v kilodaltonih). Na površini viriona se nahajajo skupaj 72 gpl20 molekul, od katerih je vsaka povezana z intramembranskim proteinom gp41. Ti proteini skupaj z dvojno lipidno plast tvori supercapsid (membrano) viriona.
Proteini gpl20 in gp41 nastanejo kot posledica celičnega proteaznega rezanja predhodnega proteina Env. Protein gp41 tvori "čep" hrbtenice, ki jo povezuje citoplazemska domena s proteinom p17MA matriksa neposredno pod membrano. Molekule p17, ki sodelujejo z zorenjem virionov, tvorijo ikošeder, ki leži pod lupino.
V osrednjem delu viriona proteina p24 tvori konični kapsid. Zoženi del kapsida s sodelovanjem beljakovine pb je povezan z ovojnico viriona. V kapsidu sta dve enaki molekuli virusne genomske RNK. Vezani so na svojih 5 'koncih do proteina nukleokapsida p7NC. Ta protein je zanimiva, ker ima dva aminokislinska ostanka (motiv), cistein bogati in histidin atom in vsebuje Zn, - so imenovani "cinkov prst", saj zajame molekule genomske RNA za vgradnjo v virione oblikovane. Kapsid vsebuje tudi tri encime. Reversaza (RT) ali pol-kompleks, vključuje reverzno transkriptazo, RNA-ase H in DNK-odvisno DNA-polimerazo. Revertaza je prisotna kot p66 / p51 heterodimer. Protease (PR) - pI, začne in uresničuje proces zrelosti zrnja. Integracija (IN) - p31, ali endonukleaza, zagotavlja vključitev provirne DNA v genom gostiteljske celice. Kapsid vsebuje tudi semensko RNA molekulo (tRNAl "3).
Gen RNA v celici pretvorimo z reverzno transkriptazo v DNA genom (DNA-provirus), ki vsebuje 9283 nukleotidnih parov. To je omejeno na levo in desno, tako imenovano dolga končna ponovitev, ali LTR (angleški dolgi terminski termin): S'-LTR-levo in Z'-LTR - na desni. LTR vsebuje 638 nukleotidnih parov.
Genoma za HIV sestavlja 9 genov, od katerih so nekateri prekriti (ima več bralnih okvirov) in ima eksonično strukturo. Nadzirajo sintezo 9 strukturnih in 6 regulativnih proteinov.
Vrednost LTR za virusni genom je, da vsebujejo naslednje regulativne elemente, ki nadzirajo njegovo delovanje:
- transkripcijski signal (regija promotorja);
- signal za dodajanje poli-A;
- Signal zajema;
- integracija signala;
- pozitivni regulativni signal (TAR za beljakovine TAT);
- element negativne regulacije (NRE za beljakovine NEF);
- mesto pritrditve semenske RNK (tRNA ™ 3) za sintezo minus verige DNA na 3 'koncu; signal na 5'-koncu LTR, ki služi kot primer za sintezo plus-verige DNA.
Poleg tega LTR vsebuje elemente, ki so vključeni v regulacijo mRNA spajanja, pakiranje molekul vRNA v kapsid (element Psi). Končno, pri transkripciji genoma v dolgih mRNA-ju se za protein REV generira dva signala, ki preklopita sintezo proteinov: CAR za regulatorne proteine in CRS za strukturne proteine. Če se REV protein veže na CAR, se sintetizirajo strukturni proteini; če je odsoten, se sintetizirajo le regulatorni proteini.
Pri urejanju genoma virusa imajo še posebej pomembno vlogo naslednji regulirni geni in njihovi proteini:
- beljakovine TAT, ki izvajajo pozitivni nadzor reprodukcije virusa in delujejo prek regulatornega območja TAR;
- beljakovine NEV in VPU, ki izvajajo negativen nadzor reprodukcije prek območja NRE;
- beljakovine REV, ki izvajajo pozitivno negativno kontrolo. Beljakovina REV nadzira delo genov gag, pol, env in izvaja negativno regulacijo spajanja.
Tako je razmnoževanje virusa HIV pod trojno kontrolo - pozitivno, negativno in pozitivno negativno.
Protein VIF določa infektivnost novonastavljenega virusa. Vezan je na kapsidni protein p24 in je prisoten v virionu v količini 60 molekul. Protein NEF je v virionu predstavljen z majhnim številom molekul (5-10), ki so morda povezani z ovojnico.
VPR protein inhibira celični ciklus na faze G2, uporabljene pri prevozu preintegratsionnyh kompleksov v celičnem jedru in aktivira nekatere virusne in celične gene, povečuje učinkovitost replikacije virusa monocitov in makrofagov. Lokacija proteinov VPR, TAT, REV, VPU v virionu ni določena.
Poleg lastnih beljakovin lahko sestava virionske membrane vključuje tudi nekatere proteine gostiteljske celice. Proteini VPU in VPR so vključeni v regulacijo reprodukcije virusa.
Antigenske variante virusa humane imunske pomanjkljivosti (HIV)
Virus humane imunske pomanjkljivosti (HIV) je zelo spremenljiv. Tudi iz organizma enega bolnika se lahko izolirajo sevi virusa, ki se bistveno razlikujejo pri antigenskih lastnostih. Takšno variabilnost spodbuja intenzivno uničenje celic CD4 + in močan odziv protiteles proti okužbi s HIV. Bolniki iz zahodne Afrike imajo novo obliko HIV, ki je biološko blizu HIV-1, vendar imunološko ločena od njega, HIV-2. Homologija primarne strukture genomov teh virusov je 42%. DNA-provirus virusa HIV-2 vsebuje 9671 bp, njegov LTR pa 854 bp. HIV-2 je bil pozneje izoliran v drugih regijah sveta. Med HIV-1 in HIV-2 ni križne imunosti. Dve veliki obliki HIV-1 so znani: O (Outlier) in M (Major), slednji so razdeljeni na 10 podtipov (AJ). V Rusiji 8 kroži podtipov (AH).
Mehanizem interakcije HIV s celico
Po prodiranju v telo virus najprej napada celice, ki vsebujejo specifičen CD4 receptor. Ta receptor ima veliko število T-pomagačev, v manj - makrofagih in monocitih, še posebej virusno občutljivih T-pomagačih.
Virus humane imunske pomanjkljivosti (HIV) prepozna receptorje CD4 s proteinom gpl20. Postopek medsebojnega delovanja HIV z celico poteka v skladu z naslednjo shemo: adsorpcija, ki jo posreduje receptor -> obrobljena fovea -> obrobljena vezikula -> lizosom. V njej se virionska membrana združuje z lizosomsko membrano in nukleokapsid, osvobojen iz supercapsida, vstopi v citoplazmo; na poti do jedra se uniči in sproščata genomska RNA in z njimi povezane jedrne komponente. Potem reverzna transkriptaza sintetizira minus verigo DNA na virionsko RNA, potem RNA-ase H uniči virionsko RNA, in virusna DNA-polimeraza sintetizira plus-verigo DNA. Na koncih DNA-provirusa se tvorijo 5'-LTR in 3'-LTR. DNA-provirus je lahko v jedru nekaj časa v neaktivni obliki, vendar se prej ali slej integrira s pomočjo svoje integraze v kromosom ciljne celice. V njej je provirus v neaktivnem stanju, dokler se ta T-limfocit ne aktivira z mikrobnimi antigeni ali drugimi imunokompetentnimi celicami. Aktiviranje transkripcije celične DNK ureja poseben jedrski faktor (NF-kB). To je DNA-vezavni protein in se proizvaja v velikih količinah med aktivacijo in proliferacijo T-limfocitov in monocitov. Ta protein se veže na specifična zaporedja celične DNA in podobne sekvence LTR-DNA-provirusa in inducira transkripcijo celične DNA in DNA-provirusa. Z indukcijo transkripcije DNA-provirusa prehaja virus iz neaktivnega stanja v aktivno in s tem tudi obstojno okužbo v produktivno. Ostani provirus v neaktivnem stanju lahko traja zelo dolgo. Aktiviranje virusa je kritičen trenutek v interakciji s celico.
Od trenutka, ko virus vnese v celico, se začne okužba z virusom HIV, virus, ki lahko traja 10 let ali več; in ker aktivacija virusa začne bolezen - AIDS. S pomočjo njihovih regulativnih genov in njihovih produktov se virus aktivno pomnoži. TAT-protein lahko poveča stopnjo razmnoževanja virusa 1000-krat. Transkripcija virusa je zapletena. Vključuje nastanek celokupne in subgenomske mRNA, spajanje mRNA in nadaljnjo sintezo strukturnih in regulatornih proteinov.
Sinteza strukturnih proteinov se pojavi kot sledi. Sprva sintetiziramo poliprotein prekurzorja Pr55Gag (protein z m. M. 55 kD). Vsebuje štiri glavne domene: matriksu (MA), kapsidni (CA), nukleokapsid (NC) in domene pe, katerih posledica rezanja Pr55Gag virusne proteaze (IT samovyrezaetsya iz drugega proteina prekurzorja - gag-pol) vsakokrat tvorjena strukturni proteini P17 , p24, p7 in pb. Tvorba poliproteina Pr55Gag je glavni pogoj za nastanek virusnih delcev. Ta protein določa program morfogeneze viriona. Vključuje korake zaporedno gag poliproteina prevoz na plazemski membrani in njegovo interakcijo s proteinom proteinskih interakcijah pri tvorbi virusnega delca in njegovega brstenja. Pr55Gag se sintetizira na prostih polibriozoma; proteinske molekule se prevažajo na membrano, na kateri se sidrajo s svojimi hidrofobnimi obliži. Glavno vlogo pri ustvarjanju naravne konformacije proteina Gag igra domena CA. NC-domena stikalo zagotavlja (s pomočjo "cinkovih prstov") 2 molekule genomske RNA v virusni delec, ki tvori. Molekula poliproteina najprej dimerizira zaradi interakcije matričnih domen. Nato dimeri združene v hexameric (6 enot) kompleksov z interakcijo domen CA in NC. Nazadnje heksamer, ki povezujejo stranski ploskvi tvorijo nezrela virionov kroglaste oblike, znotraj katere vsebujejo virusne genomske RNA ujetega NC-domeno.
Še en prekurzorski proteinski Prl60Gag-Pol (protein z m. M. 160 kDa) sintetiziramo kot posledica premika bralni okvir za ribosoma med prevajanjem Z'-terminus gag gena v območje neposredno pred kodirno regijo RB protein. Ta poliprotein Gag-Pol vsebuje nepopolno zaporedje Gagovih proteinov (1 - 423 aminokislin) in Pol sekvenc, ki vključujejo področja PR, RT in IN. Molekule poliproteinov Gag-Pol so tudi sintetizirane na prostih polibromozah in jih prevažajo v plazemsko membrano. Poliprotein Prl60Gagpol vsebuje vsa mesta intermolekularnih interakcij, ki so prisotna v poliproteinskih gagih in na mestih za vezavo membrane. Zato molekul poliproteina gag-pol varovalko z membrano in skupaj z gag-molekule vključujejo tvorijo virione, ki bi lahko privedlo do prične aktivno proteazo in virioni zorenja. Proteaza HIV-1 je zelo aktivna le v obliki dimerja, zato je za njegovo samozapiranje iz Prl60Gag-Pol potrebna dimerizacija teh molekul. Zorenje viriona je, da sproščena aktivna proteaza zmanjša prl60Gag-Pol in Gag55 v prepoznavna mesta; proteini p17, p24, p7, p6, revertaza, integraza in njihova povezava v virusni strukturi.
Env protein sintetiziramo na ribosomov povezanih z membranah endoplazemski retikulum, glikoziliran in potem se reši celično proteaze za gp120 in gp41 in se transportira na celični površini. V tem primeru gp41 permeira membrano in se veže na matrične domene proteinske molekule Gag, povezane z notranjo površino membrane. To razmerje ostaja v zrelih virionih.
Tako sestavljanje virusnih delcev je združevanje predhodnikov beljakovin in sorodnih RNA molekul na plazemsko membrano gostiteljske celice, tvorbo nezrelih virionov in sprostitvi se z brstenjem iz celične površine. Pri nihanju se virion obdaja s celično membrano, v kateri so vgrajene molekule gp41 in gp120. Med brstenjem ali po možnosti po pojavi sproščanje virionovo zorenja, ki se izvaja s pomočjo virusne proteaze proteolitični rezalnih Pr55Gag predhodnikov beljakovin in virus Prl60Gag-Pol zrel proteinov in njihovo združenje za posebne strukturne kompleksov. Vodilno vlogo pri morfogeneza virusa ima poliprotein prekurzorsko Pr55Gag, ki organizira in sestavlja nezrele virion; Proces njegovega zorenja dopolnjuje specifična virusna proteaza.
Vzroki za imunsko pomanjkljivost
Eden od glavnih vzrokov imunskega pomanjkanja okužbe s HIV je masa smrti T-pomagačev. Do tega pride zaradi naslednjih dogodkov. Prvič, virusi T-helper, okuženi z virusom, umrejo zaradi apoptoze. Menijo, da so bolniki z replikacijo virusa aidsa, apoptoza in zmanjšanje števila T-celice pomagalke med seboj povezani. Drugič, T-celice ubijalke prepoznati in uničiti T-celice, okužene z virusom ali nosijo molekulo adsorbiranima gpl20 ter virusom okuženih in virusom okuženih T-celice pomagalke, ki tvorijo symplasts (syncytia), ki sestoji iz več deset celic (del umirajo kot posledica množenja virusov v njih). Zaradi uničenje velikega števila T-celice pomagalke pojavi izraz zmanjšanje membrana receptorja pri B limfocitov na IL-2, motena sinteza različnih interlevkina (rastnih faktorjev in diferenciacijo limfocitov B -. IL-4, IL-5, IL-6, in drugi) zaradi česar je kršena funkcija sistema T-morilec. Pojavi se supresija aktivnosti komplementa in makrofagnih sistemov. -Virus okuženih makrofagov in monocite dolgo, da bi umrl, vendar niso mogli odstraniti virus iz telesa. Poleg tega je zaradi strukturnih in antigenskih podobnosti z receptorji gpl20 nekaj epitelne celice organizma (vključno Trofoblast Receptor posredovanje prenos presaditev HIV) sintetiziramo antiretseptornyh protiteles s širokim spektrom delovanja. Taka protitelesa so sposobna blokirati različne celične receptorje in zaplete potek bolezni avtoimunskih motenj. Posledica okužbe z virusom HIV je poraz vseh glavnih delov imunskega sistema. Takšni bolniki postanejo brezobzirni proti širokemu razponu mikroorganizmov. To vodi k razvoju oportunističnih okužb in neoplastičnih bolezni. Pri bolnikih, okuženih s HIV, imajo povečano tveganje za razvoj raka z vsaj tremi vrstami Kaposijevega sarkoma; karcinomi (vključno z rakom kože); B-celični limfom, ki izhaja iz maligne degeneracije B-limfocitov. Vendar pa HIV nima samo limfocitov, ampak tudi nevrotropnega. To penetrira v CŽS celice (astrocitov) bodisi z endocitozo in fagocitoze astrocitov z virusom okužene limfoblasti receptorsko posredovano. V interakciji virusa s astrocitov se oblikujejo tudi symplasts prispevajo k širjenju patogena medceličnih kanalov. V makrofagov in monocite, lahko virus traja dolgo časa, tako da služi kot rezervoar in njegovimi distributerji v telesu, da lahko prodre v vseh tkivih. Okuženi makrofagi imajo pomembno vlogo pri migraciji virusa HIV v osrednji živčni sistem in njenega poraza. Pri 10% bolnikov s primarnim kliničnih sindromov, povezanih s CNS in prikazane v obliki demence (demence). Tako je za ljudi z infekcijo s HIV prizadetih označen s 3 skupinami bolezni - oportunističnih okužb, tumorjev in CNS.
Epidemiologija okužbe s HIV
Vir okužbe z virusom HIV je samo oseba - bolan ali virusni nosilec. Virus humane imunske pomanjkljivosti (HIV) najdemo v krvi, semenu, materničnem vratu; pri doječih materah - v materino mleko. Okužba se pojavi spolno, prek krvi in njenih drog, pa tudi od matere do otroka pred porodom, med in po porodu. Primeri okužbe z virusom skozi hrano, pijačo in ugrizi žuželk niso znani.
Zasvojenost z drogami prispeva k širjenju aidsa. Okužba z virusom HIV se vsako leto poveča. Po podatkih Svetovne zdravstvene organizacije je od leta 1980 do leta 2000 okuženih s HIV okuženih 58 milijonov ljudi. Leta 2000 je bilo na svetu okuženih 5,3 milijona ljudi, 3 milijone ljudi pa je umrlo zaradi aidsa. V Rusiji je od 1. Januarja 2004 bilo registriranih 264.000 HIV pozitivnih ljudi. Polovica okuženih s HIV umre v 11-12 letih okužbe. V začetku leta 2004 je od vsakih 100.000 ruskih državljanov z diagnozo okužbe z virusom HIV živelo okoli 180 ljudi. Predvideva se, da bo na tej stopnji incidence skupno število okuženih z virusom HIV v Rusiji do leta 2012 2,5-3 milijona ljudi. Kompleksnost boja proti okužbi z virusom HIV je odvisna od številnih razlogov: prvič, ni učinkovitih načinov zdravljenja in posebnega preprečevanja; Drugič, obdobje inkubacije okužbe z virusom HIV lahko presega 10 let. Trajanje je odvisno od trenutka aktivacije T-limfocitov in DNA-provirusa, ki ga vsebuje njen kromosom. Ni še jasno, ali je vsak virus, okužen z aidsom, obsojen ali ima verjetno dolgoročni virus brez bolezni (kar se zdi malo verjetno). Končno, obstaja več človeških virusov imunske pomanjkljivosti (HIV-1, HIV-2), antigenske razlike med katerimi preprečujejo nastanek navzkrižne imunosti. Odkrivanje virusa imunske pomanjkljivosti opic (SIV) je osvetlilo izvor HIV. SIO za organizacijo genoma je podoben virusu HIV, vendar se bistveno razlikuje v nukleotidnem zaporedju. HIV-2 serološko zaseda vmesni položaj med HIV-1 in SIV in nukleotidna sekvenca je bila bližja SIV. V tem pogledu je VM Zhdanov predlagal, da virusi HIV-1, HIV-2 in SIV izhajajo iz skupnega prednika. Po mnenju R. Galla je mogoče, da je eden od SIV nekako prišel v človeško telo, kjer je prebolel številne mutacije, kar je povzročilo HIV-1, HIV-2 in druge oblike.
Simptomi okužbe s HIV
Za virus humane imunske pomanjkljivosti so značilne nekatere značilnosti, na katere je patogeneza bolezni v veliki meri odvisna. Virus ima zelo visoko stopnjo razmnoževanja, ki jo določajo njegovi regulatorni elementi (5.000 virionov se sintetizira v 5 minutah v aktivni fazi). Zaradi prisotnosti fuzijskega proteina (gp41) virus povzroča nastanek obsežnih sincicijskih struktur zaradi fuzije okuženih in neinficiranih T-pomagačev, kar povzroči njihovo masovno smrt. Molekule velikih molekul gpl20 prosto krožijo v krvi in se vežejo na receptorje neokuženih T-pomagačev, zaradi česar jih prepoznajo in uničijo T-morilci. Virus se lahko razširi skozi celične kanale iz celice v celico, v tem primeru postane manj protitelesa na voljo.
Klinična merila za okužbo s HIV
Adult HIV ugotoviti, če imajo vsaj dve resni simptomi, v kombinaciji z vsaj enim simptom mladoletnika v odsotnosti drugih znanih vzrokov oslabljenim imunskim sistemom (rak, prirojeno imunsko pomanjkljivostjo, hudo lakoto, in tako naprej. P.). Resni simptomi vključujejo:
- izguba teže za 10% ali več;
- dolgotrajna zvišana telesna temperatura, občasno ali vztrajno;
- kronična driska.
Manjši simptomi: trajni kašelj, generalizirani dermatitis, ponavljajoči se herpes zoster, kandidoza ustne votline in žrela, kronični herpes simplex, generalizirana limfadenopatija. Diagnoza AIDS-a je narejena s prisotnostjo samo kaposijevega sarkoma, kriptokoknega meningitisa, pneumokistične pljučnice. Na klinično sliko bolezni vpliva oportunistična okužba.
Metode gojenja virusa humane imunske pomanjkljivosti (HIV)
HIV-1 in HIV-2 lahko gojimo v celicah le enega klona TCB4-limfocitov - H9, pridobljenih iz levkemičnih TCV4-limfocitov. Za iste namene se lahko uporabijo tudi monolojne kulture astrocitnih celic, v katerih se HIV-1 dobro razmnoži. Od živali do okužb s HIV-1, ki so občutljive na šimpanze.
Odpornost virusa v zunanjem okolju je nizka. Umre pod vplivom sončne svetlobe in UV-sevanja, uniči se pri 80 ° C 30 minut, ko se zdravi z običajno uporabljenimi razkužili - 20-30 minut. Za razkuževanje materiala, ki vsebuje virus, je potrebno uporabljati mikobakterijske razkužila, saj so učinkoviti proti mikroorganizmom z največjo odpornostjo.
Laboratorijska diagnoza okužbe s HIV
Glavni način diagnosticiranja virusov in okužbe z virusom HIV je imunski test encimov. Vendar pa zaradi dejstva, da je gpl20 strukturno in antigenski podobna receptorje nekaterih humanih celic, vključno z receptorji, ki izvajajo prevoz imunoglobulinov hrbet epitelnih celic sluznice v telesu lahko pojavijo protiteles, povezanih protiteles proti gpl20. V tem primeru so morda lažno pozitivni rezultati IFM. Zato se vsi pozitivno reagirajoči serumi proučevanih podvržejo dodatni analizi z metodo imunoblota ali zahodnega blotiranja. Metoda temelji na določitvi testnih protiteles po elektroforetsko ločitev in njihovo nadaljnjo preskušanja z nadaljnjimi markiranimi protitelesi antispecies. Virološka metoda je zaradi kompleksnosti kulture virusa malo uporabna. Klon limfocitov H9 se uporablja za pridobivanje virusnih antigenov - potrebnih komponent diagnostičnih testnih sistemov. Metoda CDR omogoča odkrivanje virusa že v zgodnji fazi viremije.
Zdravljenje okužbe s HIV
Potrebno je najti ali sintetizirati zdravila, ki učinkovito zavirajo aktivnost reverzne transkriptaze (revertaze) ali virusne proteaze. Preprečili bi nastanek DNA-provirusa in (ali) zavirali intracelično množenje virusa. Sedanja strategija za zdravljenje okuženih s HIV temelji na načelu kombinirane uporabe zdravil, ki zavirajo virusno proteazo (eno od zdravil) in reversijo (2 različna zdravila), kombinirano (trojno) terapijo. V Rusiji, za zdravljenje HIV okuženih ljudi priporočamo kombinirano uporabo dveh lokalnih zdravil: CRIXIVAN Phosphazide in specifično zavirajo razmnoževanje virusa HIV v zgodnjih in poznih fazah vzreje, predvsem z zmanjšano aktivnostjo AZT.
Problem specifičnega preprečevanja je potreba po oblikovanju cepiva, ki bi zagotovil nastanek učinkovite celične imunosti na osnovi citotoksičnih limfocitov, specifičnih za virus, brez znatne produkcije protiteles. Takšno imuniteto nudijo Thl-pomočniki. Možno je, da protitelesa, vključno z nevtralizacijo virusa, niso samo neučinkovita pri zatiranju okužbe z virusom HIV, ampak na visoki ravni zavirajo imuniteto, posredno s celico. Zato mora cepivo proti virusu HIV predvsem izpolnjevati dve osnovni zahtevi: a) biti popolnoma varno in b) spodbujati delovanje T-citotoksičnih limfocitov. Preučujemo učinkovitost različnih variant cepiv, pridobljenih iz ubitih (inaktiviranih) virusov in posameznih antigenov z visokimi zaščitnimi lastnostmi. Taki antigeni so lahko bodisi izolirani od samih virionov ali sintetizirani kemično. Predlagamo cepivo, ki temelji na metodah genskega inženiringa. Je rekombinantni virus vakcinije, ki nosi gene HIV, odgovorne za sintezo antigenov z močnimi imunogenskimi lastnostmi. Odločitev o učinkovitosti teh cepiv traja precej časa zaradi dolgotrajnega inkubacijskega obdobja okužbe z virusom HIV in velike variabilnosti patogena. Ustvarjanje zelo učinkovitega cepiva proti virusu HIV je nujna temeljna težava.


 [
[