Medicinski strokovnjak članka
Nove publikacije
Sinteza, izločanje in presnova kateholaminov
Zadnji pregled: 06.07.2025

Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Nadledvična sredica proizvaja spojine s strukturo, ki je daleč od steroidov. Vsebujejo 3,4-dihidroksifenilno (kateholno) jedro in se imenujejo kateholamini. Mednje spadajo adrenalin, noradrenalin in dopamin beta-hidroksitiramin.
Zaporedje sinteze kateholaminov je precej preprosto: tirozin → dihidroksifenilalanin (DOPA) → dopamin → norepinefrin → adrenalin. Tirozin vstopi v telo s hrano, lahko pa se tvori tudi iz fenilalanina v jetrih pod delovanjem fenilalanin hidroksilaze. Končni produkti pretvorbe tirozina v tkivih so različni. V nadledvični meduli proces poteka do stopnje tvorbe adrenalina, v končičih simpatičnih živcev - norepinefrina, v nekaterih nevronih osrednjega živčnega sistema pa se sinteza kateholaminov konča z tvorbo dopamina.
Pretvorbo tirozina v DOPA katalizira tirozin hidroksilaza, katere kofaktorja sta tetrahidrobiopterin in kisik. Domneva se, da ta encim omejuje hitrost celotnega procesa biosinteze kateholaminov in ga zavirajo končni produkti procesa. Tirozin hidroksilaza je glavna tarča regulatornih učinkov na biosintezo kateholaminov.
Pretvorbo DOPA v dopamin katalizira encim DOPA dekarboksilaza (kofaktor - piridoksal fosfat), ki je relativno nespecifična in dekarboksilira druge aromatske L-aminokisline. Vendar pa obstajajo znaki o možnosti spreminjanja sinteze kateholaminov s spreminjanjem aktivnosti tega encima. Nekaterim nevronom primanjkuje encimov za nadaljnjo pretvorbo dopamina, ta pa je končni produkt. Druga tkiva vsebujejo dopamin beta-hidroksilazo (kofaktorji - baker, askorbinska kislina in kisik), ki dopamin pretvarja v norepinefrin. V nadledvični meduli (vendar ne v končičih simpatičnih živcev) je prisoten feniletanolamin - metiltransferaza, ki iz norepinefrina tvori adrenalin. V tem primeru S-adenozilmetionin služi kot donor metilnih skupin.
Pomembno si je zapomniti, da sintezo feniletanolamin-N-metiltransferaze sprožijo glukokortikoidi, ki vstopajo v medulo iz skorje preko portalnega venskega sistema. To lahko pojasni dejstvo, da sta v enem organu združeni dve različni endokrini žlezi. Pomen glukokortikoidov za sintezo adrenalina poudarja dejstvo, da se celice nadledvične medule, ki proizvajajo noradrenalin, nahajajo okoli arterijskih žil, medtem ko celice, ki proizvajajo adrenalin, prejemajo kri predvsem iz venskih sinusov, ki se nahajajo v skorji nadledvične žleze.
Razgradnja kateholaminov poteka predvsem pod vplivom dveh encimskih sistemov: katehol-O-metiltransferaze (COMT) in monoaminooksidaze (MAO). Glavne poti razgradnje adrenalina in noradrenalina so shematsko prikazane na sliki 54. Pod vplivom COMT v prisotnosti darovalca metilne skupine S-adrenosilmetionina se kateholamini pretvorijo v normetanefrin in metanefrin (3-O-metilni derivati noradrenalina in adrenalina), ki se pod vplivom MAO pretvorita v aldehide in nato (v prisotnosti aldehid oksidaze) v vanililmandljevo kislino (VMA), glavni produkt razgradnje noradrenalina in adrenalina. V istem primeru, ko so kateholamini sprva izpostavljeni MAO in ne COMT, se pretvorijo v 3,4-dioksomandljev aldehid, nato pa pod vplivom aldehid oksidaze in COMT v 3,4-dioksomandljevo kislino in VMC. V prisotnosti alkoholne dehidrogenaze lahko iz kateholaminov nastane 3-metoksi-4-oksifenilglikol, ki je glavni končni produkt razgradnje adrenalina in noradrenalina v osrednjem živčevju.
Razgradnja dopamina je podobna, le da njegovim presnovkom manjka hidroksilna skupina na beta-ogljikovem atomu, zato namesto vanililmandljeve kisline nastane homovanilična kislina (HVA) oziroma 3-metoksi-4-hidroksifenilocetna kislina.
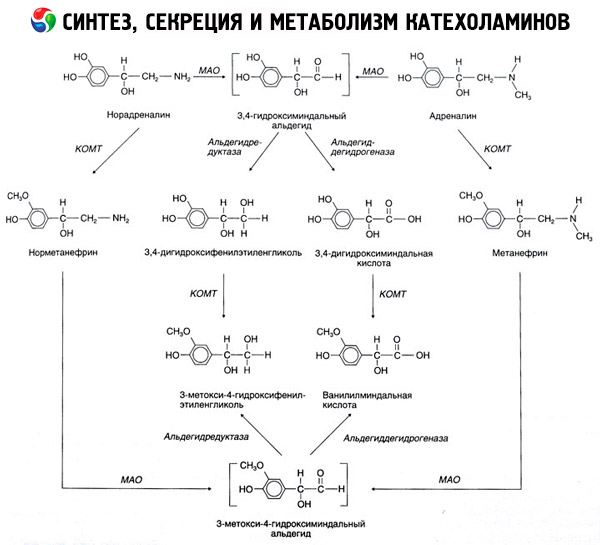
Predpostavlja se tudi obstoj kvinoidne poti oksidacije molekule kateholamina, ki lahko povzroči vmesne produkte z izrazito biološko aktivnostjo.
Norepinefrin in adrenalin, ki nastaneta pod delovanjem citosolnih encimov v simpatičnih živčnih končičih in nadledvični sredici, vstopita v sekretorne granule, kar jih ščiti pred delovanjem razgradnih encimov. Zajem kateholaminov z granulami zahteva porabo energije. V kromafinskih granulah nadledvične sredice so kateholamini tesno vezani na ATP (v razmerju 4:1) in specifične beljakovine - kromogranine, kar preprečuje difuzijo hormonov iz granul v citoplazmo.
Neposredni dražljaj za izločanje kateholaminov je očitno prodiranje kalcija v celico, ki spodbuja eksocitozo (zlitje granulne membrane s celično površino in njihovo razpoko s popolno sprostitvijo topne vsebine - kateholaminov, dopamin beta-hidroksilaze, ATP in kromograninov - v zunajcelično tekočino).
Fiziološki učinki kateholaminov in njihov mehanizem delovanja
Učinki kateholaminov se začnejo z interakcijo s specifičnimi receptorji ciljnih celic. Medtem ko so receptorji za tiroidne in steroidne hormone lokalizirani znotraj celic, so receptorji za kateholamine (kot tudi za acetilholin in peptidne hormone) prisotni na zunanji površini celic.
Že dolgo je ugotovljeno, da sta adrenalin ali noradrenalin pri nekaterih reakcijah učinkovitejša od sintetičnega kateholamina izoproterenola, medtem ko je pri drugih učinek izoproterenola boljši od delovanja adrenalina ali noradrenalina. Na tej podlagi je bil razvit koncept o prisotnosti dveh vrst adrenoreceptorjev v tkivih: alfa in beta, pri čemer je v nekaterih od njih lahko prisotna le ena od teh dveh vrst. Izoproterenol je najmočnejši agonist beta-adrenoreceptorjev, medtem ko je sintetična spojina fenilefrin najmočnejši agonist alfa-adrenoreceptorjev. Naravni kateholamini - adrenalin in noradrenalin - lahko interagirajo z receptorji obeh vrst, vendar ima adrenalin večjo afiniteto do beta-, noradrenalin pa do alfa-receptorjev.
Kateholamini aktivirajo srčne beta-adrenergične receptorje močneje kot beta-receptorje gladkih mišic, kar je omogočilo razdelitev beta tipa na podtipe: beta1-receptorje (srce, maščobne celice) in beta2-receptorje (bronhiji, krvne žile itd.). Učinek izoproterenola na beta1-receptorje presega učinek adrenalina in noradrenalina le 10-krat, medtem ko na beta2-receptorje deluje 100–1000-krat močneje kot naravni kateholamini.
Uporaba specifičnih antagonistov (fentolamin in fenoksibenzamin za alfa- in propranolol za beta-receptorje) je potrdila ustreznost klasifikacije adrenoreceptorjev. Dopamin lahko interagira tako z alfa- kot z beta-receptorji, vendar imajo tudi različna tkiva (možgani, hipofiza, žile) svoje dopaminergične receptorje, katerih specifični blokator je haloperidol. Število beta-receptorjev se giblje od 1000 do 2000 na celico. Biološki učinki kateholaminov, ki jih posredujejo beta-receptorji, so običajno povezani z aktivacijo adenilat ciklaze in povečanjem znotrajcelične vsebnosti cAMP. Čeprav sta receptor in encim funkcionalno povezana, gre za različni makromolekuli. Gvanozin trifosfat (GTP) in drugi purinski nukleotidi sodelujejo pri modulaciji aktivnosti adenilat ciklaze pod vplivom hormonsko-receptorskega kompleksa. Zdi se, da s povečanjem aktivnosti encima zmanjšujejo afiniteto beta receptorjev za agoniste.
Pojav povečane občutljivosti denerviranih struktur je že dolgo znan. Nasprotno pa dolgotrajna izpostavljenost agonistom zmanjša občutljivost ciljnih tkiv. Študija beta receptorjev je omogočila razlago teh pojavov. Dokazano je, da dolgotrajna izpostavljenost izoproterenolu vodi do izgube občutljivosti adenilat ciklaze zaradi zmanjšanja števila beta receptorjev.
Proces desenzibilizacije ne zahteva aktivacije sinteze beljakovin in je verjetno posledica postopnega nastajanja ireverzibilnih hormonsko-receptorskih kompleksov. Nasprotno, vnos 6-oksidopamina, ki uničuje simpatične končiče, spremlja povečanje števila reagirajočih beta-receptorjev v tkivih. Možno je, da povečanje aktivnosti simpatičnega živčevja povzroči tudi starostno desenzibilizacijo krvnih žil in maščobnega tkiva v odnosu do kateholaminov.
Število adrenoreceptorjev v različnih organih lahko nadzorujejo drugi hormoni. Tako estradiol poveča, progesteron pa zmanjša število alfa-adrenoreceptorjev v maternici, kar spremlja ustrezno povečanje in zmanjšanje njenega kontraktilnega odziva na kateholamine. Če je znotrajcelični "drugi prenašalec", ki nastane z delovanjem agonistov beta-receptorjev, zagotovo cAMP, potem je situacija glede prenašalca alfa-adrenergičnih učinkov bolj zapletena. Predpostavlja se obstoj različnih mehanizmov: zmanjšanje ravni cAMP, povečanje vsebnosti cAMP, modulacija celične dinamike kalcija itd.
Za reprodukcijo različnih učinkov v telesu so običajno potrebni odmerki adrenalina, ki so 5–10-krat manjši od noradrenalina. Čeprav je slednji učinkovitejši glede na a- in beta1-adrenoreceptorje, je pomembno vedeti, da sta oba endogena kateholamina sposobna interakcije z alfa- in beta-receptorji. Zato je biološki odziv določenega organa na adrenergično aktivacijo v veliki meri odvisen od vrste receptorjev, ki so v njem prisotni. Vendar to ne pomeni, da je selektivna aktivacija živčne ali humoralne povezave simpatično-adrenalnega sistema nemogoča. V večini primerov opazimo povečano aktivnost njegovih različnih povezav. Tako je splošno sprejeto, da hipoglikemija refleksno aktivira nadledvično sredico, medtem ko znižanje krvnega tlaka (posturalna hipotenzija) spremlja predvsem sproščanje noradrenalina iz končičev simpatičnih živcev.
Adrenoreceptorji in učinki njihove aktivacije v različnih tkivih
Sistem, organ |
Vrsta adrenergičnih receptorjev |
Reakcija |
Kardiovaskularni sistem: |
||
Srce |
Beta |
Povečan srčni utrip, prevodnost in kontraktilnost |
Arteriole: |
||
Koža in sluznice |
Alfa |
Zmanjšanje |
Skeletne mišice |
Beta |
Širitev Krčenje |
Trebušni organi |
Alfa (več) |
Zmanjšanje |
Beta |
Podaljšek |
|
Žile |
Alfa |
Zmanjšanje |
Dihalni sistem: |
||
Mišice bronhijev |
Beta |
Podaljšek |
Prebavni sistem: |
||
Želodec |
Beta |
Zmanjšane motorične sposobnosti |
Črevesje |
Alfa |
Krčenje sfinktrov |
Vranica |
Alfa |
Zmanjšanje |
Beta |
Sprostitev |
|
Eksokrini trebušni slinavki |
Alfa |
Zmanjšano izločanje |
Urogenitalni sistem: |
Alfa |
Krčenje sfinktra |
Mehur |
Beta |
Sprostitev izmetalne mišice |
Moški spolni organi |
Alfa |
Ejakulacija |
Oči |
Alfa |
Razširitev zenic |
Usnje |
Alfa |
Povečano potenje |
Žleze slinavke |
Alfa |
Izločanje kalija in vode |
Beta |
Izločanje amilaze |
|
Endokrine žleze: |
||
Otočki trebušne slinavke |
||
Beta celice |
Alfa (več) |
Zmanjšano izločanje insulina |
Beta |
Povečano izločanje insulina |
|
Alfa celice |
Beta |
Povečano izločanje glukagona |
8-celična |
Beta |
Povečano izločanje somatostatina |
Hipotalamus in hipofiza: |
||
Somatotrofi |
Alfa |
Povečano izločanje STH |
Beta |
Zmanjšano izločanje STH |
|
Laktotrofi |
Alfa |
Zmanjšano izločanje prolaktina |
Tirotrofi |
Alfa |
Zmanjšano izločanje TSH |
Kortikotrofi |
Alfa |
Povečano izločanje ACTH |
| beta | Zmanjšano izločanje ACTH | |
Ščitnica: |
||
Folikularne celice |
Alfa |
Zmanjšano izločanje tiroksina |
Beta |
Povečano izločanje tiroksina |
|
Parafolikularne (K) celice |
Beta |
Povečano izločanje kalcitonina |
Obščitnične žleze |
Beta |
Povečano izločanje PTH |
Ledvice |
Beta |
Povečano izločanje renina |
Želodec |
Beta |
Povečano izločanje gastrina |
BX |
Beta |
Povečana poraba kisika |
Jetra |
? |
Povečana glikogenoliza in glukoneogeneza s sproščanjem glukoze; povečana ketogeneza s sproščanjem ketonskih teles |
Maščobno tkivo |
Beta |
Povečana lipoliza s sproščanjem prostih maščobnih kislin in glicerola |
Skeletne mišice |
Beta |
Povečana glikoliza s sproščanjem piruvata in laktata; zmanjšana proteoliza z zmanjšanim sproščanjem alanina in glutamina |
Pomembno je upoštevati, da rezultati intravenske uporabe kateholaminov ne odražajo vedno ustrezno učinkov endogenih spojin. To velja predvsem za norepinefrin, saj se v telesu sprošča predvsem ne v kri, temveč neposredno v sinaptične špranje. Zato endogeni norepinefrin aktivira na primer ne le alfa receptorje v žilju (zvišan krvni tlak), temveč tudi beta receptorje srca (povečan srčni utrip), medtem ko vnos norepinefrina od zunaj vodi predvsem do aktivacije alfa receptorjev v žilju in refleksne (preko vagusa) upočasnitve srčnega utripa.
Nizki odmerki adrenalina aktivirajo predvsem beta receptorje mišičnih žil in srca, kar povzroči zmanjšanje perifernega žilnega upora in povečanje srčnega iztisa. V nekaterih primerih lahko prevlada prvi učinek in po dajanju adrenalina se razvije hipotenzija. V višjih odmerkih adrenalin aktivira tudi alfa receptorje, kar spremlja povečanje perifernega žilnega upora in ob ozadju povečanega srčnega iztisa povzroči zvišanje arterijskega tlaka. Vendar pa se ohrani tudi njegov učinek na beta receptorje v žilah. Posledično povečanje sistoličnega tlaka preseže podoben kazalnik diastoličnega tlaka (povečanje pulznega tlaka). Z uvedbo še višjih odmerkov začnejo prevladovati alfa-mimetični učinki adrenalina: sistolični in diastolični tlak se vzporedno povečujeta, kot pod vplivom noradrenalina.
Vpliv kateholaminov na presnovo je sestavljen iz njihovih neposrednih in posrednih učinkov. Prvi se uresničujejo predvsem prek beta receptorjev. Bolj zapleteni procesi so povezani z jetri. Čeprav se povečana jetrna glikogenoliza tradicionalno šteje za posledico aktivacije beta receptorjev, obstajajo tudi dokazi o vpletenosti alfa receptorjev. Posredni učinki kateholaminov so povezani z modulacijo izločanja mnogih drugih hormonov, kot je inzulin. Pri učinku adrenalina na njegovo izločanje očitno prevladuje alfa adrenergična komponenta, saj je bilo dokazano, da vsak stres spremlja zaviranje izločanja inzulina.
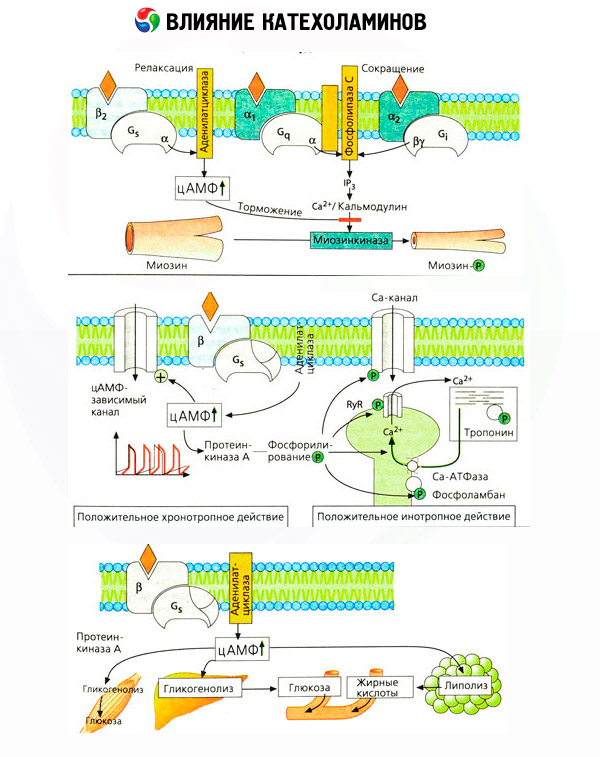
Kombinacija neposrednih in posrednih učinkov kateholaminov povzroča hiperglikemijo, ki je povezana ne le s povečano proizvodnjo glukoze v jetrih, temveč tudi z zaviranjem njene izkoriščanja v perifernih tkivih. Pospešitev lipolize povzroča hiperlipacidemijo s povečanim dovajanjem maščobnih kislin v jetra in intenziviranjem proizvodnje ketonskih teles. Povečana glikoliza v mišicah vodi do povečanega sproščanja laktata in piruvata v kri, ki skupaj z glicerolom, sproščenim iz maščobnega tkiva, služita kot predhodnika jetrne glukoneogeneze.
Regulacija izločanja kateholaminov. Podobnost produktov in načinov reakcije simpatičnega živčnega sistema in nadledvične medule je bila osnova za združitev teh struktur v enoten simpatično-adrenalni sistem telesa z dodelitvijo njegovih živčnih in hormonskih povezav. Različni aferentni signali so koncentrirani v hipotalamusu in središčih hrbtenjače in podolgovate medule, od koder izvirajo eferentna sporočila, ki prehajajo na celična telesa preganglionskih nevronov, ki se nahajajo v stranskih rogovih hrbtenjače na ravni VIII vratnih - II-III ledvenih segmentov.
Preganglionski aksoni teh celic zapustijo hrbtenjačo in tvorijo sinaptične povezave z nevroni, ki se nahajajo v ganglijih simpatične verige ali s celicami nadledvične sredice. Ta preganglionska vlakna so holinergična. Prva temeljna razlika med simpatičnimi postganglionskimi nevroni in kromafinimi celicami nadledvične sredice je v tem, da slednje prenašajo holinergični signal, ki ga prejmejo, ne po živčni prevodnosti (postganglionski adrenergični živci), temveč po humoralni poti, pri čemer sproščajo adrenergične spojine v kri. Druga razlika je v tem, da postganglionski živci proizvajajo norepinefrin, medtem ko celice nadledvične sredice proizvajajo predvsem adrenalin. Ti dve snovi imata različen učinek na tkiva.

